题目内容
14.下列与化学反应能量变化相关的叙述正确的是( )| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 酒精可用作燃料,说明酒精燃烧是释放能量的反应 | |
| C. | 干冰气化需要吸收大量的热,这个变化是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
分析 A、焓变等于生成物能量与反应能量差;
B、燃烧都是放热反应;
C、干冰气化是物理变化;
D、焓变与反应条件无关.
解答 解:A、生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,故A错误;
B、燃烧都是放热反应,故B正确;
C、吸热反应是指化学反应,干冰气化是物理变化,故C错误;
D、根据△H=生成物的焓-反应物的焓可知,焓变与反应条件无关,在光照和点燃条件下该反应的△H相同,故D错误.
故选:B.
点评 本题考查了焓变与反应条件无关、燃烧是放热反应、吸热反应和放热反应是指化学变化、焓变与反应条件无关,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.下列示意图与对应的反应情况正确的是( )
| A. |  含0.01 mol NaOH和0.01 mol Ba(OH)2的混合溶液中缓慢通入CO2 | |
| B. |  KHCO3溶液中逐滴加入Ba(OH)2溶液 | |
| C. | 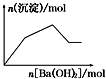 KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 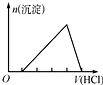 向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸 |
5.历史上最早应用的还原性染料是靛蓝,其结构简式如图.下列关于靛蓝的叙述中错误的是( )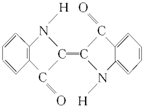

| A. | 该物质属于芳香族化合物 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 靛蓝完全燃烧生成二氧化碳和水 | D. | 它是不饱和的有机物 |
2.物质不需要通过化学变化就能体现的性质是( )
| A. | 可燃性 | B. | 不稳定性 | C. | 挥发性 | D. | 还原性 |
9.在标准状况下,11.2L某气体的质量是16g,该气体可能是( )
| A. | O2 | B. | N2 | C. | H2 | D. | CO2 |
19.由1-丙醇制取 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )
a.氧化 b.还原 c.取代 d.加成e.消去 f.中和 g.缩聚 h.酯化.
 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )a.氧化 b.还原 c.取代 d.加成e.消去 f.中和 g.缩聚 h.酯化.
| A. | b、d、f、g、h | B. | e、d、c、a、h | C. | a、e、d、c、h | D. | b、a、e、c、f |
6.下列说法正确的是( )
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被还原 |