题目内容
9.在标准状况下,11.2L某气体的质量是16g,该气体可能是( )| A. | O2 | B. | N2 | C. | H2 | D. | CO2 |
分析 根据n=$\frac{V}{{V}_{m}}$计算11.2L该气体的物质的量,再根据M=$\frac{m}{n}$计算该气体的摩尔质量,结合选项判断.
解答 解:11.2L该气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
故该气体的摩尔质量为$\frac{16g}{0.5mol}$=326g/mol,
即该气体为O2;
故选A.
点评 本题考查常用化学计量的有关计算、相对分子质量的计算等,比较基础,注意基础知识的掌握.

练习册系列答案
相关题目
19.以下关于氟、氯、溴、碘的性质叙述错误的是( )
| A. | HF、HCl、HBr、HI稳定性逐渐减弱 | |
| B. | 单质F2、Cl2、Br2、I2中,与氢气化合最容易的是F2 | |
| C. | HF、HCl、HBr、HI中酸性最强的是HF | |
| D. | 单质F2、Cl2、Br2、I2中,I2的沸点最高 |
20.下列溶液中,与100mL 0.5mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
| A. | 200 mL 0.25mol/L CaCl2溶液 | B. | 200 mL 0.25mol/L HCl溶液 | ||
| C. | 50 mL 1mol/L NaCl溶液 | D. | 100 mL 0.5mol/L MgCl2溶液 |
17.在恒温、恒容的密闭容器中反应A(g)?B(g)+C(g)△H<0(放热反应).若反应物的浓度由3mol/L降到2mol/L需10s,那么反应物浓度由2mol/L降到1mol/L所需时间为( )
| A. | 大于10s | B. | 等于10s | C. | 小于10s | D. | 无法判断 |
4.厨房中的物质放入足量的水中,充分搅拌,不能形成溶液的是( )
| A. | 食用油 | B. | 白醋 | C. | 白糖 | D. | 食盐 |
14.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 酒精可用作燃料,说明酒精燃烧是释放能量的反应 | |
| C. | 干冰气化需要吸收大量的热,这个变化是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
18.对下列各种溶液中所含离子的判断合理的是( )
| A. | 某无色溶液中可能含:SO42-、Br-、OH-、Ba2+ | |
| B. | 使紫色石蕊试液变红色的溶液中可能含:K+、Na+、Ba2+、HCO3- | |
| C. | 某溶液中,加铝粉有氢气放出,溶液中可能含:K+、Na+、H+、NO3- | |
| D. | 在c(H+)=10-14mol/L的溶液中可能含:Na+、AlO2-、CO32-、SO32- |
18.工业上产生的氮氧化物可用天然气来处理.
Ⅰ.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
N2(g)+2O2(g)=2NO2(g)△H2
H2O(l)=H2O(g)△H3
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=△H1-△H2+2△H3(用△H1、△H2、△H3)
Ⅱ.在温度为T1℃和T2℃时,分别将0.50molCH4和1.2molNO2充入体积固定的2L密闭容器中,发生上述可逆反应,测得不同时刻的n(CH4)数据如下表:
(1)分析上表中数据,下列说法正确的是BC
A.T1℃、前10min,V(NO2)=0.03mol/(L•min)
B.T1℃、反应达化学平衡状态时,CH4的转化率为80%
C.T2℃、反应在40min时处于平衡状态
D.T1>T2
(2)反应的平衡常数K(T1)>K(T2),△H<0,理由是由表中数据可知,T2时反应速率较大,所以T1<T2;升高温度平衡逆向移动,可知K(T1)>K(T2),所以正反应放热.
(3)T1℃时反应的平衡常数K为3.2.
(4)反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2,在下图中画出恒温,重新达到平衡过程中n(CH4)随时间变化的曲线(只要求画出n(CH4)的变化趋势,不需要准确画出再次平衡后n(CH4).
Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为NO2-e-+NO3-=N2O5.

Ⅰ.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
N2(g)+2O2(g)=2NO2(g)△H2
H2O(l)=H2O(g)△H3
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=△H1-△H2+2△H3(用△H1、△H2、△H3)
Ⅱ.在温度为T1℃和T2℃时,分别将0.50molCH4和1.2molNO2充入体积固定的2L密闭容器中,发生上述可逆反应,测得不同时刻的n(CH4)数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
A.T1℃、前10min,V(NO2)=0.03mol/(L•min)
B.T1℃、反应达化学平衡状态时,CH4的转化率为80%
C.T2℃、反应在40min时处于平衡状态
D.T1>T2
(2)反应的平衡常数K(T1)>K(T2),△H<0,理由是由表中数据可知,T2时反应速率较大,所以T1<T2;升高温度平衡逆向移动,可知K(T1)>K(T2),所以正反应放热.
(3)T1℃时反应的平衡常数K为3.2.
(4)反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2,在下图中画出恒温,重新达到平衡过程中n(CH4)随时间变化的曲线(只要求画出n(CH4)的变化趋势,不需要准确画出再次平衡后n(CH4).
Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为NO2-e-+NO3-=N2O5.

 ;
;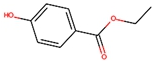 ;
;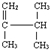 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯;