��Ŀ����
����Ŀ����ѧ��Ӧ���������������������������
��1��Aѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������200mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£��ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 464 | 576 | 620 |
�ٷ�Ӧ��������ʱ����ǣ�ָ0��1��1��2��2��3��3��4��4��5 ��min��ԭ���� ��
����2��3����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ���� �� ������Һ������䣩
��2��Bѧ��Ҳ��ͬ����ʵ�飬�����ڷ�Ӧ̫�죬�ⲻ�������������취���ͷ�Ӧ���ʣ��������ѡ���������м��������Լ�����Ӧ���ʣ�����д���ţ�
A.����ˮ
B.����
C.HNO3��Һ
D.CuSO4��Һ
��3��ij�¶�����10L�ܱ������У�3����̬����A��B��C�����ʵ�����ʱ��仯������ͼ�� 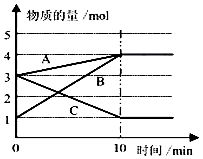
�ٸ÷�Ӧ�Ļ�ѧ����ʽ�� ��
�����ڸ������ﵽ��Ӧ���ȣ�ƽ��״̬��ʱ��Ӧ���ת���ʡ�ת����= ![]() ��100%������д��������̣�����������1λС����
��100%������д��������̣�����������1λС����
���𰸡�
��1��2��3����÷�Ӧ���ȣ����ŷ�Ӧ����Һ�¶����ߣ��ʷ�Ӧ���ʼӿ죻0.1mol/��L?min��
��2��AB
��3��2C?A+3B���⣺CΪ��Ӧ����ʼ���ʵ���Ϊ3mol��ƽ��ʱΪ3mol����C��ת����Ϊ�� ![]() ��100%=66.7%
��100%=66.7%
���������⣺��1���ٴӱ������ݿ���2 min��3 min�ռ�������������ʱ��ζ࣬��Ȼ��Ӧ��c��H+���½�������Ҫԭ����Zn�û�H2�ķ�Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ����Դ��ǣ�2��3����÷�Ӧ���ȣ����ŷ�Ӧ����Һ�¶����ߣ��ʷ�Ӧ���ʼӿ죻����2��3minʱ����ڣ����ɱ�������������Ϊ��232mL��120mL=112mL��n��H2��=0.005mol����2HCl��H2��֪��������������ʵ���Ϊ0.01mol�� ��ԣ�HCl��= ![]() =0.1 mol/��Lmin����
=0.1 mol/��Lmin����
���Դ��ǣ�0.1 mol/��Lmin������2��A����������ˮ����Һ��Ũ�ȼ�С����Ӧ���ʼ�С��H+�����ʵ������䣬������������Ҳ���䣬������������A��ȷ��
B�����������¶Ƚ��ͣ���Ӧ���ʼ�С��H+�����ʵ������䣬������������Ҳ���䣬������������B��ȷ��
C������HNO3��Һ���������ǿ�����ԣ��������Ӧ����NO������������������C����
D������CuSO4��Һ��п��ͭ���ӷ�Ӧ����ͭ������ͭпԭ��أ��ӿ��˷�Ӧ���ʣ���D�������Դ��ǣ�AB����3������ͼ����Կ�������Ӧ��A��B�����ʵ������ӣ�C�����ʵ������٣���A��BΪ�����CΪ��Ӧ��ҡ�n��A������n��B������n��C��=1mol��3mol��2mol=1��3��2����Ӧ�Ļ�ѧ����ʽΪ��2CA+3B��
���Դ��ǣ�2CA+3B��
��CΪ��Ӧ����ʼ���ʵ���Ϊ3mol��ƽ��ʱΪ3mol����C��ת����Ϊ�� ![]() ��100%=66.7%��
��100%=66.7%��
�𣺸������ﵽ��Ӧ���ȣ�ƽ��״̬��ʱ��Ӧ���ת����Ϊ66.7%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�