题目内容
【题目】将2.3 g钠放入100 g水中,生成溶液中溶质的质量分数是
A. 等于2.3% B. 等于4% C. 大于2.3% D. 大于4%
【答案】C
【解析】
根据钠与水反应生成氢氧化钠和氢气的方程式算出反应后溶质氢氧化钠的质量,再算出氢气质量,再计算出溶液质量,根据计算公式再算出所得溶液的质量分数。
设2.3克金属钠与水反应生成氢氧化钠的质量为X,生成氢气质量为Y,由化学方程式可得:
2Na+2H2O═2NaOH+H2↑
46 80 2
2.3g X Y
46:2.3=80:X=2:Y,解得X=4g;Y=0.1g,反应后所得溶液的质量分数:4g/(100g+2.3g0.1g)
×100%≈3.91%,故选C。

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 )min,原因是 .
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率 . (设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列以减慢反应速率.(填写代号)
A.蒸馏水
B.冰块
C.HNO3溶液
D.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图. 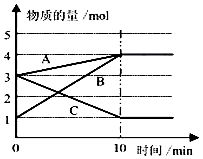
①该反应的化学方程式是 .
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率= ![]() ×100%】,请写出计算过程,计算结果保留1位小数)
×100%】,请写出计算过程,计算结果保留1位小数)