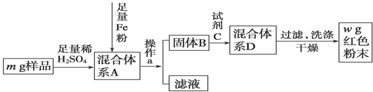
题目内容
7.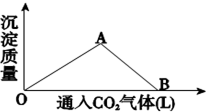 如图为一定量饱和 Ca(OH)2溶液中通入二氧化碳气体后,产生 CaCO3 白色沉淀的质量与二氧化碳体积之间的关系曲线.
如图为一定量饱和 Ca(OH)2溶液中通入二氧化碳气体后,产生 CaCO3 白色沉淀的质量与二氧化碳体积之间的关系曲线.试回答:OA 段所表示的反应离子方程式是:Ca2++2OH-+CO2=CaCO3↓+H2O,
AB 段所表示的反应化学方程式是:CaCO3+CO2+H2O=Ca(HCO3)2,
将 B 处生成的溶液煮沸,可见到的现象是白色沉淀和气体生成.
分析 在Ca(OH)2溶液中通入二氧化碳气体,先生成CaCO3(不溶于水),再转化为Ca(HCO3)2(能溶于水),加热时Ca(HCO3)2分解又生成了不溶性的CaCO3;据此分析完成各题.
解答 解:OA段:在Ca(OH)2溶液中通入二氧化碳气体,先生成CaCO3(不溶于水),反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O,离子方程式为:Ca2++2OH-+CO2=CaCO3↓+H2O;
AB段:当碱消耗完,再通入二氧化碳,二氧化碳与碳酸钙、水继续反应生成Ca(HCO3)2(溶于水),反应离子方程式为:CaCO3+CO2+H2O=Ca(HCO3)2.
B处的是Ca(HCO3)2溶液,Ca(HCO3)2不稳定,受热易分解:Ca(HCO3)2=CaCO3↓+CO2↑+H2O,故将B处的溶液煮沸,现象是有白色沉淀和气体生成.
故答案为:Ca2++2OH-+CO2=CaCO3↓+H2O;CaCO3+CO2+H2O=Ca(HCO3)2;白色沉淀和气体生成.
点评 本题考查了离子反应及离子反应方程式书写,题目难度中等,注意氢氧化钙与二氧化碳的反应,二氧化碳的加入量影响反应产物,该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练.

练习册系列答案
相关题目
1.实验室收集下列各组气体,选用相同方法的一组是( )
| A. | H2和HCl | B. | CO2和H2 | C. | CO2和HCl | D. | CO2和NH3 |
15.下列实验操作或做法正确的是( )
| A. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液小火加热蒸干 | |
| B. | 配制100ml1.00mol/L的NaCl溶液,需用托盘天平准确称量5.9g氯化钠固体 | |
| C. | 利用蒸馏的方法进行乙醇与水的分离时,温度计水银球应放在液面以下来准确测定温度 | |
| D. | 用浓硫酸配制一定物质的量的浓度的稀硫酸时,向浓硫酸中加水稀释,冷却至室温后才能够移到容量瓶 |
2.在一密闭容器中,反应m A(g)+n B(g)?3C(g)达到平衡时,测得c(A)=0.5mol/L.在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L.下列判断中正确的是( )
| A. | A的质量分数增大 | B. | 化学计量数:m+n>3 | ||
| C. | 平衡向右移动 | D. | 物质C的体积分数减小 |
12.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 71g氯气通入足量水中,反应生成的HClO分子数为NA | |
| B. | 1mol硝基与NA个二氧化氮气体分子所含电子数相等 | |
| C. | 在反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2中,每生成1molO2该反应共转移的电子数为6NA | |
| D. | 1L 1mol/LAlCl3溶液中所含阳离子数小于NA |
19.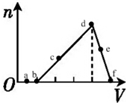 向一定物质的量浓度的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3的物质的量随NaOH加入量的变化关系如图所示.则下列物质在对应的溶液中一定能大量存在的是( )
向一定物质的量浓度的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3的物质的量随NaOH加入量的变化关系如图所示.则下列物质在对应的溶液中一定能大量存在的是( )
 向一定物质的量浓度的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3的物质的量随NaOH加入量的变化关系如图所示.则下列物质在对应的溶液中一定能大量存在的是( )
向一定物质的量浓度的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3的物质的量随NaOH加入量的变化关系如图所示.则下列物质在对应的溶液中一定能大量存在的是( )| A. | a点对应的溶液中:Na+、Fe3+、SO42-、HCO3- | |
| B. | c点对应的溶液中:Na+、AlO2-、SO42-、NO3- | |
| C. | d点对应的溶液中:Ag+、Ca2+、NO3-、Cl- | |
| D. | f点对应的溶液中:K+、OH-、I-、CO32- |