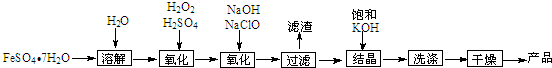
题目内容
1.工业生产硝酸铵的流程如图1所示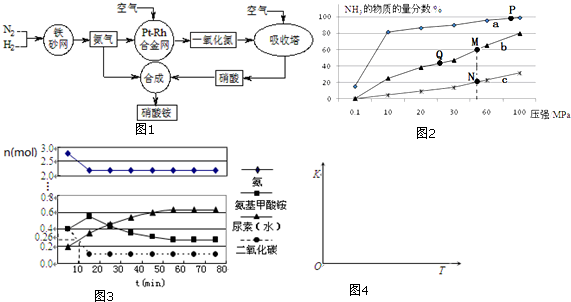
(1)硝酸铵的水溶液呈酸性(填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(2)已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图2.
①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是ACDE
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.M点对应的H2转化率是75%
E.如果N点时c(NH3)=0.2mol•L-1,N点的化学平衡常数K≈0.93
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:第一步:2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1
第二步:H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2(s)△H=-134kJ/mol
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图3所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第二步反应决定,总反应进行到55min时到达平衡.
②反应进行到10min时测得CO2的物质的量如图4所示,则用CO2表示的第一步反应的速率v(CO2)=0.148mol•L-1•min-1.
③在图中画出第二步反应的平衡常数K随温度的变化的示意图.
分析 (1)硝酸铵的水溶液中铵根离子水解会使溶液呈酸性,硝酸铵中硝酸根和铵根离子溶液相等,但部分铵根水解,浓度减小,据此判断离子浓度大小;
(2)①依据反应是放热反应,温度升高,平衡逆向进行,氨气的含量减小;
②A、减小生成物浓度平衡正向移动;B、P点原料气的平衡转化率接近100%,但此时压强为100MPa,对设备的要求太高,成本高,不是当前工业生产工艺中采用的温度、压强条件;C、K只受温度影响,该反应温度升高时K值减小;D、M点时氨的物质的量的分数为60%,根据反应N2(g)+3H2(g)?2NH3(g)利用三段式计算;E、根据反应N2(g)+3H2(g)?2NH3(g)利用三段式计算出平衡时各物质的浓度,并计算平衡常数;
(3)根据盖斯定律,①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;将①+②可得以NH3、CO2为原料合成尿素的热化学方程式;
(4)①已知总反应的快慢由慢的一步决定,结合图象变化趋势,图象表达反应的判断,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;
②根据图象中二氧化碳在10 min时测得CO2的物质的量计算出用CO2表示的第一步反应的速率v(CO2);
③第二步反应为吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,据此画图.
解答 解:(1)硝酸铵的水溶液中铵根离子水解会使溶液呈酸性,硝酸铵中硝酸根和铵根离子溶液相等,但部分铵根水解,浓度减小,所以溶液中离子浓度大小关系是c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸性;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(2)①合成氨的反应为放热反应,反应温度越高,越不利于反应的进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;
故答案为:200℃;
②A、及时分离出NH3,可以使平衡正向进行,可以提高H2的平衡转化率,故A正确;
B、P点原料气的平衡转化率接近100%,但此时压强为100MPa,对设备的要求太高,成本高,不是当前工业生产工艺中采用的温度、压强条件,故B错误;
C、平衡常数与温度有关,与其他条件无关,同一温度下的平衡常数相同,反应是放热反应,温度越高平衡常数越小,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
D、M点时氨的物质的量的分数为60%,利用三段式,设H2转化率是x
根据反应N2(g)+3H2(g)?2NH3(g)
起始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$=60%,所以x=0.75,故D正确;
E、N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)?2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
根据题意有$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}=20%}\\{2ab=0.2mol/L}\end{array}\right.$,所以a=0.3mol•L-1,b=$\frac{1}{3}$,所以平衡常数K=$\frac{({2ab)}^{2}}{(a-ab)•(3a-3ab)^{3}}$=0.93,故E正确;
故答案为:ACDE;
(3)根据盖斯定律,①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;将①+②可得以NH3、CO2为原料合成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2(s)△H=-134kJ/mol,
故答案为:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol;
(4)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二部反应,从曲线斜率不难看出第二步反应速率慢,所以合成尿素总反应的快慢由第二步反应决定,根据图可知,尿素在55分钟时,物质的量不再变化,即反应达到平衡,所以总反应进行到55min时到达平衡,
故答案为:二;55;
②反应进行到10 min时测得CO2的物质的量为0.26mol,二氧化碳的浓度变化为:c(CO2)=$\frac{1mol-0.26mol}{0.5L}$=1.48mol/L,
则用CO2表示的第一步反应的速率v(CO2)=$\frac{1.48mol/L}{10min}$=0.148 mol/(L•min),
故答案为:0.148;
③第二步反应为吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,所以第二步反应的平衡常数K随温度的变化的示意图为: ,
,
故答案为: .
.
点评 本题考查了热化学方程式的书写、化学平衡的计算,题目难度较大,注意掌握盖斯定律的内容及应用方法,能够利用三段式进行化学平衡的计算,明确反应速率的概念及计算方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力.

| A. | 71g氯气通入足量水中,反应生成的HClO分子数为NA | |
| B. | 1mol硝基与NA个二氧化氮气体分子所含电子数相等 | |
| C. | 在反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2中,每生成1molO2该反应共转移的电子数为6NA | |
| D. | 1L 1mol/LAlCl3溶液中所含阳离子数小于NA |
| A. | CH4+2O2═CO2+2H2O;△H=-889.6 kJ•mol-1 | |
| B. | CH4 (g)+2O2 (g)═CO2 (g)+2H2O (g);△H=-889.6kJ•mol-1 | |
| C. | CH4 (g)+2O2 (g)═CO2 (g)+2H2O ( l );△H=889.6kJ•mol-1 | |
| D. | CH4(g)+2O2 (g)═CO2 (g)+2H2O ( l );△H=-889.6kJ•mol-1 |
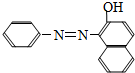 2005年2月,我国政府就含有添加“苏丹红一号“色素的食品可能诱发癌症发出警告,并全面清剿苏丹红.“苏丹红一号“结构简式如图.有关“苏丹红一号“的下列叙述中不正确的是 ( )
2005年2月,我国政府就含有添加“苏丹红一号“色素的食品可能诱发癌症发出警告,并全面清剿苏丹红.“苏丹红一号“结构简式如图.有关“苏丹红一号“的下列叙述中不正确的是 ( )| A. | 分子式为C16H12N2O | |
| B. | 能与浓溴水发生取代反应 | |
| C. | 能与氯化铁溶液作用使溶液呈紫色 | |
| D. | 因苏丹红一号中含有酚羟基,故可被空气氧化产生醛基 |