题目内容
11.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )| A. | 元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | 元素Z、R的氧化物的水化物之间相互反应生成的盐一定是正盐 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
分析 X、Y、Z、W、R 5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则A为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素,据此解答.
解答 解:X、Y、Z、W、R 5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则A为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素.
A.Y、Z、W元素形成的简单离子分别为O2-、Na+、Al3+,O2-、Na+、Al3+核外电子数都是10,具有相同电子层结构,半径随着核电荷数的增加而减小,所以离子半径O2->Na+>Al3+,故A错误;
B.39g Na2O2的物质的量是0.5mol,阴离子为0.5mol,阳离子为1mol,所以含有的离子数约为1.5×6.02×1023=9.03×1023,故B错误;
C.S与Na的氧化物的水化物之间相互反应生成的盐可能是正盐,也可能是酸式盐,故C错误;
D.O的非金属性强于S的非金属性,所以H2O的热稳定性大于H2S的热稳定性,故D正确,
故选D.
点评 本题考查元素原子结构与元素周期律的关系,推断元素是解题关键,难度中等,注意微粒半径比较规律.

| A. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O═C6H5OH+HCO3- | |
| B. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+2H2O | |
| D. | 醋酸溶液中加入少量CaCO3固体:CaCO3+2H+═Ca2++H2O+CO2↑ |
| A. | 钚是f 区元素 | B. | 核外电子数238 | C. | 核内中子数 144 | D. | 钚是锕系元素 |
| A. | W元素是硅元素 | |
| B. | 气态氢化物的稳定性:Y<R | |
| C. | X、W、Y的最高价氧化物的水化物酸性强弱顺序是X<Y<W | |
| D. | X、Y、W、R的原子半径由大到小的顺序为R>W>X>Y |
| A. | 乙烯的比例模型: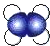 | B. | 3,3-二甲基戊烷的键线式: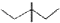 | ||
| C. | 对甲基苯甲醇的结构简式: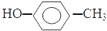 | D. | 醛基的结构简式:-CHO |
| A. | s区 | B. | p区 | C. | d 区 | D. | ds区 |
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
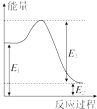
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
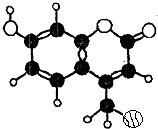 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )