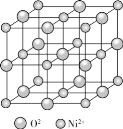
题目内容
【题目】在下列条件下,两种气体的分子数一定相等的是
A.同质量、不同密度的N2和C3H6;B.同温度、同体积的O2和N2;
C.同体积、同密度的CO和C2H4;D.同压强、同体积的O2和N2。
【答案】C
【解析】
利用阿伏加德罗定律和阿伏加德罗推论进行分析。
利用n=![]() ,即分子数相等,气体物质的量相等,
,即分子数相等,气体物质的量相等,
A. N2的摩尔质量为28g·mol-1,C3H6的摩尔质量为42g·mol-1,即同质量的两种气体,其气体物质的量不同,故A错误;
B. 根据PV=nRT,同温度、同体积的O2和N2,因压强不知是否相等,因此无法推出N2和O2物质的量是否相等,故B错误;
C. 根据密度的定义,同体积、同密度,推出这两种气体质量相等,CO和C2H4的摩尔质量都是28g·mol-1,推出CO和C2H4物质的量也相等,故C正确;
D. 根据PV=nRT,同压强,同体积,不知温度是否相等,因此无法判断O2和N2物质的量是否相等,故D错误;
答案:C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目