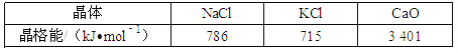��Ŀ����
����Ŀ����������̼���º���{[Ni(CHZ)3](ClO4)2}��һ�����͵���ҩ��
��1��Ni����CO�γ������Ni(CO)4������CO���ṩ�µ��ӶԵ���Cԭ�ӣ������ɿ�����__��������������������������Ŀ֮��Ϊ__��
��2����ClO4-�Ŀռ乹����___��
��д����ClO4-��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӣ�__��__��(�ѧʽ)
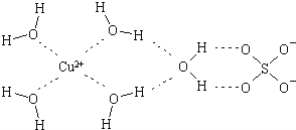
��3����ѧʽ��CHZΪ̼���£���ṹΪ![]() ������һ�����͵Ļ�����¯ˮ��������
������һ�����͵Ļ�����¯ˮ��������
��̼�����е�Ԫ�صĻ��ϼ�Ϊ__��̼ԭ�ӵ��ӻ��������Ϊ__��
��̼���¿�����̼�������(![]() )����(N2H4)��Ӧ�Ƶã��йصĻ�ѧ����ʽΪ__��
)����(N2H4)��Ӧ�Ƶã��йصĻ�ѧ����ʽΪ__��
��4����������̼���º�������NiO�������ἰ̼���»��϶��ɡ�
�ٱȽϴ��������������ԣ���˵�����ɣ�___��
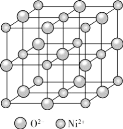
����ͼΪNiO�������������к��е�Ni2+��ĿΪa��Ni2+����λ��Ϊb��NiO������ÿ��Ni2+���������Ni2+��ĿΪc����a��b��c=__��
���𰸡��縺��O>C��Oԭ�Ӳ������µ��Ӷ� 1:1 ���������� CCl4 SO42 2 sp2  HClO4�����Ա�HClO��ǿ��HClO4�з��ǻ�����Ŀ��HClO�Ķ࣬HClO4��Cl�������Ը��ߣ�����ClOH��O�ĵ�����Cl��ƫ�Ƴ̶ȱ�HClO�Ĵ�HClO4�������H+ 2:3:6
HClO4�����Ա�HClO��ǿ��HClO4�з��ǻ�����Ŀ��HClO�Ķ࣬HClO4��Cl�������Ը��ߣ�����ClOH��O�ĵ�����Cl��ƫ�Ƴ̶ȱ�HClO�Ĵ�HClO4�������H+ 2:3:6
��������
�ŵ縺��Խ��ԭ��Խ�����ṩ�µ��Ӷԣ�Niԭ���γɵ�4����λ������������CO��N2��Ϊ�ȵ����壬CO���ӽṹʽΪC��O��CO�����к���1��������2��������
����ClO4������ԭ��Clԭ�ӹµ��Ӷ�=![]() ���۲���Ӷ���=0+4=4�����ռ乹��������VSEPRģ����ͬ����ԭ��������ȡ��۵�������Ҳ��ȵ�����Ϊ�ȵ����塣
���۲���Ӷ���=0+4=4�����ռ乹��������VSEPRģ����ͬ����ԭ��������ȡ��۵�������Ҳ��ȵ�����Ϊ�ȵ����塣
����N��N��ʹNԪ�ر���0�ۣ�N��H��ʹNԪ�ر���-1�ۣ�N��C��ʹNԪ�ر���-1�ۣ�������̼ԭ���γ�3���������ӻ������ĿΪ3����̼���¿�����̼�������(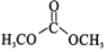 )����(N2H4)��Ӧ�Ƶã��÷�Ӧ����ȡ����Ӧ��ͬʱ���м״�����.
)����(N2H4)��Ӧ�Ƶã��÷�Ӧ����ȡ����Ӧ��ͬʱ���м״�����.
�������ǻ�����ĿԽ�࣬����Ԫ�ص�������Խ�ߣ�Խ����������ӣ������̯�����㾧���к��е�Ni2+��Ŀ���Զ���Ni2+�о�������Χ����������Ӵ��������ҹ��������ӶԳƣ���֪Ni2+����λ��Ϊ6���Զ���Ni2+�о�����֮���������Ni2+�������ģ�����12����
(1)�縺��O>C��Oԭ�Ӳ������µ��Ӷԣ�����CO���ṩ�µ��ӶԵ���Cԭ�ӡ�Niԭ���γɵ�4����λ������������CO��N2��Ϊ�ȵ����壬CO���ӽṹʽΪC��O��CO�����к���1��������2������,��Ni(CO)4�к���8��������8��������������������Ŀ֮��Ϊ8:8=1:1���ʴ�Ϊ���縺��O>C��Oԭ�Ӳ������µ��Ӷԣ�1:1��
(2)��ClO4������ԭ��Clԭ�ӹµ��Ӷ�![]() ���۲���Ӷ���=0+4=4�����ռ乹��������VSEPRģ����ͬΪ���������Σ��ʴ�Ϊ�����������Ρ�
���۲���Ӷ���=0+4=4�����ռ乹��������VSEPRģ����ͬΪ���������Σ��ʴ�Ϊ�����������Ρ�
��ԭ��������ȡ��۵�������Ҳ��ȵ�����Ϊ�ȵ����塣��ClO4��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӿ����ǣ�CCl4��SO42�ȣ��ʴ�Ϊ��CCl4��SO42��
(3)��NN��ʹNԪ�ر���0�ۣ�NH��ʹNԪ�ر���1�ۣ�NC��ʹNԪ�ر���1�ۣ���̼�����е�Ԫ�صĻ��ϼ�Ϊ2�ۣ�������̼ԭ���γ�3���������ӻ������ĿΪ3,��̼ԭ�Ӳ�ȡsp2�ӻ����ʴ�Ϊ��2��sp2��
��̼���¿�����̼�������( )����(N2H4)��Ӧ�Ƶ�,�÷�Ӧ����ȡ����Ӧ,ͬʱ���м״�����,��Ӧ����ʽΪ��
)����(N2H4)��Ӧ�Ƶ�,�÷�Ӧ����ȡ����Ӧ,ͬʱ���м״�����,��Ӧ����ʽΪ�� ;�ʴ�Ϊ��
;�ʴ�Ϊ�� .
.
(4)��HClO4�з��ǻ�����Ŀ��HClO�Ķ࣬HClO4��Cl�������Ը��ߣ�����ClOH��O�ĵ�����Cl��ƫ�Ƴ̶ȱ�HClO�Ĵ�HClO4�������H+�������ԣ�HClO4>HClO���ʴ�Ϊ��HClO4�����Ա�HClO��ǿ��HClO4�з��ǻ�����Ŀ��HClO�Ķ࣬HClO4��Cl�������Ը��ߣ�����ClOH��O�ĵ�����Cl��ƫ�Ƴ̶ȱ�HClO�Ĵ�HClO4�������H+��
�������к��е�Ni2+��Ŀ![]() ���Զ���Ni2+�о�������Χ����������Ӵ��������ҹ��������ӶԳƣ���֪Ni2+����λ��Ϊ6���Զ���Ni2+�о�����֮���������Ni2+�������ģ�����Ϊ8���������á�����Ϊ2���������ã��ʹ���3��82=12������a:b:c=4:6:12=2:3:6���ʴ�Ϊ��2:3:6��
���Զ���Ni2+�о�������Χ����������Ӵ��������ҹ��������ӶԳƣ���֪Ni2+����λ��Ϊ6���Զ���Ni2+�о�����֮���������Ni2+�������ģ�����Ϊ8���������á�����Ϊ2���������ã��ʹ���3��82=12������a:b:c=4:6:12=2:3:6���ʴ�Ϊ��2:3:6��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ͭ�ǹ㷺Ӧ�������������Ԫ�������úϽ�ij����С���ij�Ͼ���ͭԪ��(��25%BeO��71%CuS������FeS��SiO2)�л������ͭ���ֽ����Ĺ���������ͼ��
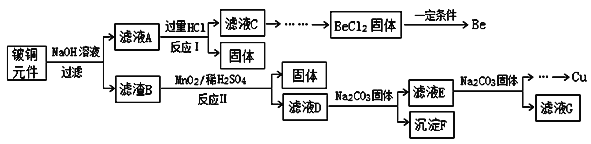
��֪��I���롢��Ԫ�ػ�ѧ�������ƣ�
�����²�����������ܶȻ����������
������ | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
�ܶȻ�����(Ksp) | 2.2��10��20 | 4.0��10��38 | 2.1��10��13 |
(1)��ҺA����Ҫ�ɷֳ�NaOH��Na2BeO2�⣬����___________(�ѧʽ)��д����ӦI��Na2BeO2��������ᷴӦ�����ӷ���ʽ��________��
(2)��ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2���������ʵ�鲽��˳��Ϊ_______(����ĸ)
a.��������İ�ˮ b.ͨ�������CO2 c.���������NaOH d.����������HCl e.ϴ�� f.����
(3)MnO2�ܽ����������е���Ԫ������Ϊ���ʣ�д����Ӧ����CuS������Ӧ�Ļ�ѧ����ʽ��___________������ŨHNO3�ܽ�������ȱ����_______(��дһ��)��
(4)��ҺD��c(Cu2+)��2.2mol��L��1��c(Fe3+)��8.0��10��3mol��L��1��c(Mn2+)��0.01mol��L��1����μ���Na2CO3��Һ����pH�ɽ���ת��������������η��룬���ȳ�������_______(�����ӷ���)��Ϊʹͭ���ӿ�ʼ������������Ӧ������Һ��pH����______��
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����������˵���������ǣ��� ��
���� | X | Y | Z |
��ʼŨ��/ | 0.1 | 0.2 | 0 |
ƽ��Ũ��/ | 0.05 | 0.05 | 0.1 |
A.��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50��
B.��Ӧ�ɱ�ʾΪX+3Y![]() 2Z����ƽ�ⳣ��Ϊ1600
2Z����ƽ�ⳣ��Ϊ1600
C.�ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
D.��ѹʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������