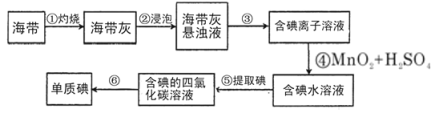
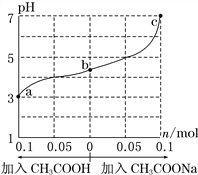
��Ŀ����
����Ŀ�������ֽ�������A��B��C������A����ɫ��ӦΪ��ɫ��B��C�dz�����������C�ĺϽ�����������ֽ�������A��B��C������ס��ҡ���������D��E��F��G��H֮�䷢������ת����ϵ(ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û�б��)��

�����������Ϣ�ش��������⣺
(1)����A��ԭ�ӽṹʾ��ͼ��_______________________________________��
(2)д���������ʵĻ�ѧʽ�� H��__________���ң�________________��
(3)C��һ���������Ǿ��д��Եĺ�ɫ���壬��������Ļ�ѧʽ��_____________��
(4)д����Ӧ�ٵ����ӷ���ʽ����Ӧ��______________________________��
(5)д����Ӧ�ڵĻ�ѧ����ʽ����Ӧ��___________________________________��
(6)������ҺE�������ӵij��÷�����____________________��
���𰸡�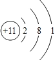 Fe(OH)3 Cl2 Fe3O4 Fe+2H+��Fe2++H2�� 2Al+2NaOH+2H2O��2NaAlO2+3H2�� �������ữ��AgNO3,���ְ�ɫ������֤����Cl-
Fe(OH)3 Cl2 Fe3O4 Fe+2H+��Fe2++H2�� 2Al+2NaOH+2H2O��2NaAlO2+3H2�� �������ữ��AgNO3,���ְ�ɫ������֤����Cl-
��������
�����ֽ�������A��B��C������A����ɫ��ӦΪ��ɫ����ɫ��ӦΪ��ɫ��˵��������һ��������Ԫ�أ���AΪ����Na��Na��ˮ��Ӧ����NaOH�������������������D����Һ���������ƣ�����ɫ������������������Ϊ������������������Ӧ����HCl�����ΪHCl��E�����ᣬ���ɫ�ij���һ�����������������Խ���C������F���Ȼ�������G���Ȼ������ܺ��������Ʒ�Ӧ���������Ľ���ֻ����������B�ǽ�������
��1��AΪNaԭ������ԭ�ӵĺ�����������11����3�����Ӳ㣬����������Ϊ1�� ԭ�ӽṹʾ��ͼΪ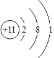 ���ʴ�Ϊ��
���ʴ�Ϊ��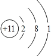 ��
��
��2���ɷ�����֪��HΪFe(OH)3����ΪCl2���ʴ�Ϊ��Fe(OH)3��Cl2��
��3���������������У����д��Եĺ�ɫ������Fe3O4���ʴ�Ϊ��Fe3O4��
��4����Ӧ��Ϊ����ϡ���ᷴӦ�����Ȼ���������������ѧ����ʽΪFe��2HCl��FeCl2��H2�������ӷ���ʽΪFe+2H+��Fe2++H2�����ʴ�Ϊ��Fe+2H+��Fe2++H2����
��5����Ӧ��Ϊ��������������Һ��Ӧ����ƫ�����ƺ���������ѧ����ʽΪ2Al��2NaOH��2H2O��2NaAlO2��3H2�����ʴ�Ϊ��2Al��2NaOH��2H2O��2NaAlO2��3H2����
��6����ҺE���Ȼ�����Һ����������ΪCl-������Cl-�ķ������������ữ��AgNO3�����ְ�ɫ������֤����Cl-���ʴ�Ϊ���������ữ��AgNO3�����ְ�ɫ������֤����Cl-��