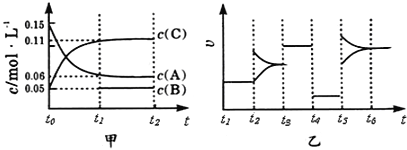
题目内容
【题目】25 ℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
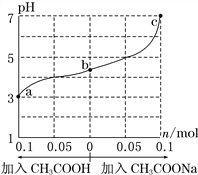
A. b点混合液中c(Na+)>c(CH3COO-)
B. 加入CH3COOH过程中,![]() 增大
增大
C. c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
【答案】C
【解析】A. 根据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),b点混合液中pH<7,则c(H+)>c(OH-),故c(Na+)<c(CH3COO-),选项A错误;B.加入CH3COOH过程中,c(CH3COO-)和c(H+)增大,c(OH-)减小,c(Na+)不变,![]() 减小,选项B错误;C. 根据物料守恒c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w,选项C正确;D.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c三点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是c>b>a,选项D错误。答案选C。
减小,选项B错误;C. 根据物料守恒c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w,选项C正确;D.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c三点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是c>b>a,选项D错误。答案选C。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】下表是三种难溶金属硫化物的溶度积常数(25 ℃):下列有关说法中正确的是
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
A. 25 ℃时,将CuS固体用含Mn2+的饱和溶液浸泡可溶解CuS固体
B. 25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol·L-1
C. 除去某溶液中的Cu2+,可以选用FeS作沉淀剂
D. 因为H2SO4是强酸,所以反应CuSO4+H2S===CuS↓+H2SO4不能发生