题目内容
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。

(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。固体B的主要成分为___________________(填化学式)。
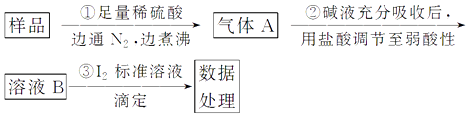
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。进一步提纯产品的方法是___________________。
(5)+6价Cr的毒性很高,工业上用电解法来处理含Cr2O72-的废水。下图为电解装置示意图,电极材料分别为铁和石墨。通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a 极附近变成Cr(OH)3沉淀而被除去。

①在以上处理过程中,Cr2O72-转化为毒性较低的Cr3+的离子方程式为________________________。
②a电极的电极反应式是是____________________;电解一段时间后在阴极区有Fe(OH)3和Gr(OH)3沉淀生成,若电解后的溶液中c(Cr3+)为3×10-5mol·L-1,则溶液中c(Fe3+)为____________ mol·L-1。已知:Ksp=[Fe(OH)3]=4.0×10-38,K[Cr(OH)3]=6.0×10-31。
【答案】 除去Fe3+ 低温下K2Cr2O7的溶解度远小于其他组分,且随温度的降低,K2Cr2O7的溶解度明显减小 NaCl Ⅱ K2Cr2O7 Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O 94.08 重结晶 Cr2O72-+6Fe2++ 14H+=2Cr3++6Fe3++7H2O 2H++2e-=H2↑ 2×10-12
【解析】考查化学工艺流程,(1)根据题目信息,母液中含有少量的Fe3+,加碱液的目的是除去Fe3+;(2)根据温度与溶解度的关系,K2Cr2O7的溶解度受温度的影响较大,低温时K2Cr2O7的溶解度远小于其他组分,且温度降低,K2Cr2O7的溶解度受温度的影响较大;(3)母液I中加入KCl,发生Na2Cr2O7+KCl=K2Cr2O7+NaCl,采用冷却降温得到K2Cr2O7固体,即母液II中含有大量的NaCl,因此蒸发浓缩得到的固体是NaCl;冷却结晶中有大量的K2Cr2O7析出,但溶液中含有少量的K2Cr2O7,蒸发浓缩时,NaCl表面附着一部分K2Cr2O7,为了提高产率又可使能耗降低,因此需要把洗涤液转移到母液II中,达到类似富集的目的;因此固体B的主要成分是K2Cr2O7;(4)①根据操作,得出K2Cr2O7 =2.352g,纯度为2.352/2.500×100%=94.08%;进一步提纯需要重新溶解,冷却结晶,此方法叫重结晶;(5)①b电极为阳极,应是失去电子,化合价应升高,而Cr2O72-中Cr的化合价降低,因此b电极为铁,此电极反应式为Fe-2e-=Fe2+,然后利用Cr2O72-的氧化性,与Fe2+发生反应,离子反应方程方式为Cr2O72-+6Fe2++ 14H+=2Cr3++6Fe3++7H2O;②根据①的分析,a电极为阴极,电极反应式为2H++2e-=H2↑;Cr3+和Fe3+共存在同一溶液中,因此有
=2.352g,纯度为2.352/2.500×100%=94.08%;进一步提纯需要重新溶解,冷却结晶,此方法叫重结晶;(5)①b电极为阳极,应是失去电子,化合价应升高,而Cr2O72-中Cr的化合价降低,因此b电极为铁,此电极反应式为Fe-2e-=Fe2+,然后利用Cr2O72-的氧化性,与Fe2+发生反应,离子反应方程方式为Cr2O72-+6Fe2++ 14H+=2Cr3++6Fe3++7H2O;②根据①的分析,a电极为阴极,电极反应式为2H++2e-=H2↑;Cr3+和Fe3+共存在同一溶液中,因此有 ,解得c(Fe3+)=2.0×10-12mol·L-1。
,解得c(Fe3+)=2.0×10-12mol·L-1。
点睛:氧化还原反应方程式的书写是学生的一个难点,学生往往找不出反应物或生成物,或者溶液的环境选错,这是对题的理解上不透彻,如本题的(5)①根据信息,Cr2O72-在b极附近转变为Cr3+,b极为阳极,阳极上失去电子化合价升高,而现在Cr的化合价降低,因此只能说明b极的材料是Fe,Fe-2e-=Fe2+,然后还原Cr2O7-,因此有Cr2O72-+Fe2+→Fe3++Cr3+,根据化合价升降法进行配平,即Cr2O72-+6Fe2+→2Cr3++6Fe3+,Fe2+、Fe3+、Cr3+不与OH-大量共存,因此溶液显酸性,根据反应前后所带电荷数守恒、原子守恒进行配平即可。
【题型】综合题
【结束】
10
【题目】“低碳经济”正成为科学家研究的主要课题,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0 kJ·mol-1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为____________(精确到0.01)。

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是______________。
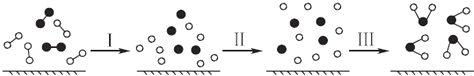
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示。

①该反应的化学方程式为______________________;反应过程中碳元素的化合价为-2价的中间体是_________________。
②向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2 mol·L-1、H2:0.8 mol·L-1、CH4:0.8 mol·L-1、H2O:1.6 mol·L-1,CO2的平衡转化率为_________________;300℃时上述反应的平衡常数K=___________________。
③已知该反应正反应放热,现有两个相同的恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是___________________(填字母)。
A.
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1
【答案】 2 +18.7kJ·mol-1 0.13mol 碳酸氢铵受热分解生成二氧化碳,氨水受热挥发 CO2+4H2![]() CH4+2H2O MgOCH2 80% 25 CD
CH4+2H2O MgOCH2 80% 25 CD
【解析】(1)考查得失电子的计算、热化学反应方程式的计算,①根据反应方程式,只有CO2中C的化合价降低,生成1molFe3O4时消耗0.5molCO2,即转移电子物质的量为0.5×4mol=2mol;②6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ①,C(s)+2H2O(g)=CO2(g)+2H2(g) ②,(①+②)/2,得出△H=(-76.0+113.4)/2kJ·mol-1=+18.7kJ·mol-1;(2)考查化学计算、化学反应控制条件,①pH=12.81,此时的CO2脱除效率为91.6%,脱除CO2的物质的量最多为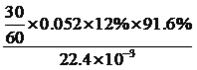 mol=0.13mol;②氨水受热易挥发,温度过高,造成氨水挥发,吸收CO2的量减少,CO2与NH3反应后生成NH4HCO3,NH4HCO3受热分解,造成CO2脱除效率降低;(3)考查化学平衡的计算、勒夏特列原理,①根据反应机理,整个过程中加入物质是CO2和H2,生成的是CH4和H2O,因此反应方程式为CO2+4H2
mol=0.13mol;②氨水受热易挥发,温度过高,造成氨水挥发,吸收CO2的量减少,CO2与NH3反应后生成NH4HCO3,NH4HCO3受热分解,造成CO2脱除效率降低;(3)考查化学平衡的计算、勒夏特列原理,①根据反应机理,整个过程中加入物质是CO2和H2,生成的是CH4和H2O,因此反应方程式为CO2+4H2![]() CH4+2H2O;Mg为+2价,H为+1价,O为-2价,因此表现-2价的中间体为MgOCH2;② CO2+4H2
CH4+2H2O;Mg为+2价,H为+1价,O为-2价,因此表现-2价的中间体为MgOCH2;② CO2+4H2![]() CH4+2H2O
CH4+2H2O
平衡: 0.2 0.8 0.8 1.6
变化:0.8 3.2 0.8 1.6
起始:1 4 0 0,CO2的转化率为0.8/1×100%=80%;根据平衡常数的定义,K= =25;③A、正反应是放热反应,反应I是向正反应方向进行,温度升高,化学速率快,反应II是向逆反应方向进行,向吸热反应方向进行,温度降低,化学反应速率变缓,故A错误;B、反应I向正反应方向进行,温度升高,容器为恒容绝热,对向正反应方向进行起到抑制,因此两个容器中CH4的质量分数不同,故B错误;C、根据B选项分析,故C正确;D、如果容器是恒温恒容,则CO2的转化率与反应II中CH4的转化率之和为1,因为是恒容绝热容器,转化率都要降低,因此两者转化率的和小于1,故D正确。
=25;③A、正反应是放热反应,反应I是向正反应方向进行,温度升高,化学速率快,反应II是向逆反应方向进行,向吸热反应方向进行,温度降低,化学反应速率变缓,故A错误;B、反应I向正反应方向进行,温度升高,容器为恒容绝热,对向正反应方向进行起到抑制,因此两个容器中CH4的质量分数不同,故B错误;C、根据B选项分析,故C正确;D、如果容器是恒温恒容,则CO2的转化率与反应II中CH4的转化率之和为1,因为是恒容绝热容器,转化率都要降低,因此两者转化率的和小于1,故D正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案