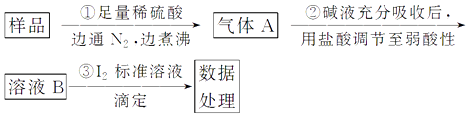
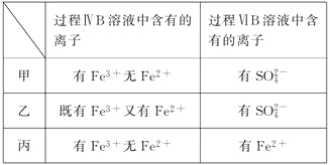
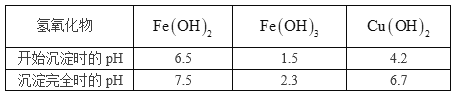
题目内容
【题目】X、Y、Z、P、Q为前四周期元素,且原子序数依次增大。X基态原子的L层有3个单电子,Z是周期表中电负性最大的元素;Y与P为同主族元素,且P基态原子的M层电子数为K层的3倍;Q2+离子的3d轨道上有9个电子。回答下列问题。
(1)基态Y原子的价电子排布图是____;P所在周期中第一电离能最大的主族元素是__________ (元素名称)。
(2)XY3-中,中心原子的杂化方式为____________;XY2-离子的立体构型是_______________。
(3)X 的氢化物比Y的氢化物沸点低的原因是_________________________。
(4)X的氢化物易形成配位键,而XZ3不易形成配位键,原因是_____________________。
(5)Y 与Q所形成的化合物晶体晶胞如图所示,该晶体的化学式:______________;晶胞参数如图所示,则该晶胞密度是_______________g·cm-3。(列式并计算结果,保留小数点后一位)。

【答案】 ![]() 氯 sp2 V型 H2O之间的氢键数目比NH3之间氢键数目多 由于氟元素的电负性比氮元素大,因此在NF3分子中,电子偏向于氟原子,使NF3分子
氯 sp2 V型 H2O之间的氢键数目比NH3之间氢键数目多 由于氟元素的电负性比氮元素大,因此在NF3分子中,电子偏向于氟原子,使NF3分子
形成配位键的能力减弱 CuO 2.1
【解析】X、Y、Z、P、Q为前四周期元素,且原子序数依次增大。X基态原子的L层有3个单电子,则X为氮元素;Z是周期表中电负性最大的元素,则Z为氟元素;Y与P为同主族元素,且P基态原子的M层电子数为K层的3倍即为6电子,故P为硫元素,Y为氧元素;Q2+离子的3d轨道上有9个电子,则基态原子价电子层的电子排布式3d104s1,Q为铜元素。(1)O为8号元素,基态O原子的价电子排布图是![]() ;同周期自左而右,第一电离能增大(个别除外),所以S所在周期中第一电离能最大的主族元素是氯;(2)NO3-中N原子价层电子对个数是3且不含孤电子对,所以N原子采用sp2杂化;NO2-中价层电子对个数=2+
;同周期自左而右,第一电离能增大(个别除外),所以S所在周期中第一电离能最大的主族元素是氯;(2)NO3-中N原子价层电子对个数是3且不含孤电子对,所以N原子采用sp2杂化;NO2-中价层电子对个数=2+![]() ×(5+1-2×2)=3且含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V型;(3)N 的氢化物比O的氢化物沸点低的原因是H2O之间的氢键数目比NH3之间氢键数目多;(4)由于氟元素的电负性比氮元素大,因此在NF3分子中,电子偏向于氟原子,使NF3分子形成配位键的能力减弱,故X的氢化物易形成配位键,而XZ3不易形成配位键;(5)根据晶胞结构可知,在晶胞中含有铜原子数是
×(5+1-2×2)=3且含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V型;(3)N 的氢化物比O的氢化物沸点低的原因是H2O之间的氢键数目比NH3之间氢键数目多;(4)由于氟元素的电负性比氮元素大,因此在NF3分子中,电子偏向于氟原子,使NF3分子形成配位键的能力减弱,故X的氢化物易形成配位键,而XZ3不易形成配位键;(5)根据晶胞结构可知,在晶胞中含有铜原子数是![]() ;含有O原子数是4×1=4,因此Cu:O=4:4=1:1,所以化学式是CuO;该晶胞是长方体,边长分别是600pm、600pm、700pm,则该晶体的密度是
;含有O原子数是4×1=4,因此Cu:O=4:4=1:1,所以化学式是CuO;该晶胞是长方体,边长分别是600pm、600pm、700pm,则该晶体的密度是 。
。

【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃。实验室可用如图装置制取ICl3。

(1)仪器a的名称是___________________。
(2)制备氯气选用的药品为漂白粉固体(主要成分为CaClO2)和浓盐酸,相关反应的化学方程式为_______________________________________。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:____________________________。
(4)试剂X为____________________________。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为___________________。
(6)欲测定上述实验制备ICl3样品中ICl3的纯度,准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI 晶体,充分反应生成I2(样品中杂质不反应)。写出反应的方程式_________________________;将所得溶液配置成100mL待测液,取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32- =2I-+ S4O62-),以淀粉溶液作指示剂,达到终点时的现象为______________________;重复滴定,实验数据记录如下:
滴定次数 | 待测液体积(mL) | Na2S2O3标准液体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 25.00 | 0.50 | 20.40 |
2 | 25.00 | 4.00 | 24.10 |
3 | 25.00 | 4.20 | 26.70 |
该样品中ICl3的质量分数为____________________。(ICl3相对分子质量为233.5)
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2Cl的电子式______________。
(2)写出NH2Cl与水反应的化学方程式_____________________。
(3)一定条件下(T℃、latm),可以用Cl2(g)和NH3(g)制得NH2Cl(g) 同时得到HCl(g)。
已知部分化学键的键能如下表:
化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式________________________。
II.亚硝酸氯(NOCl)是有机合成中重要试剂,可由NO与Cl2在一定条件下合成。保持恒温恒容条件,将物质的量之和为3mol的NO 和Cl2以不同的氮氯比(![]() )进行反应2NO(g)+Cl2(g)
)进行反应2NO(g)+Cl2(g) ![]() 2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:
2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:

(4)图中T1、T2的关系为: T1____T2(填“>”、“<”或“=”)
(5)图中纵坐标为物质(填化学式)_________的转化率,理由为______________。
(6)图中A、B、C 三点中平衡时NOCl体积分数最大的是__________(填“A”、“ B” 或“C”)
(7)若容器容积为1L,则B点平衡常数为____________。