题目内容
【题目】下列说法正确的是
A.用坩埚灼烧![]() 的反应式
的反应式 ![]()
![]()
![]()
B.根据表中提供的数据,等物质的量浓度的NaClO、![]() 混合溶液中,有
混合溶液中,有![]()
化学式 | 电离常数 |
HClO |
|
|
|
|
C.常温下,将![]() 的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一
的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一
D.某温度时,![]() 在水中的沉淀溶解平衡曲线如图所示,溶度积常数
在水中的沉淀溶解平衡曲线如图所示,溶度积常数![]() 则加入
则加入![]() 可使溶液由a点变到b点;通过蒸发可以使溶液由d点变到c点
可使溶液由a点变到b点;通过蒸发可以使溶液由d点变到c点
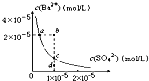
【答案】B
【解析】
![]() 加热时
加热时![]() 水解,灼烧最后得到MgO,故A错误;
水解,灼烧最后得到MgO,故A错误;
B.根据表中提供的数据,可知碳酸的酸性比次氯酸的酸性强,则等物质的量浓度的NaClO、![]() 混合溶液中,有
混合溶液中,有![]() ,由于水解程度较小,则
,由于水解程度较小,则![]() 最小,故B正确;
最小,故B正确;
C.将![]() 的稀硫酸稀释10倍,氢离子浓度减小,由于水的离子积为定值,则氢氧根离子浓度增大,故C错误;
的稀硫酸稀释10倍,氢离子浓度减小,由于水的离子积为定值,则氢氧根离子浓度增大,故C错误;
D.加入![]() 可使溶液中钡离子浓度减小,d点为不饱和溶液,蒸发时溶液离子浓度都增大,故D错误。
可使溶液中钡离子浓度减小,d点为不饱和溶液,蒸发时溶液离子浓度都增大,故D错误。
故选:B。

练习册系列答案
相关题目