题目内容
9.用如图所示的装置进行实验(盐桥中的电解质为KCl),反应一段时间后断开K,向右侧烧杯中加入0.1molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )
| A. | 锌棒为负极,其电极反应式为Zn-2e-=Zn2+ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 盛H2SO4溶液的烧杯质量减少0.2g | |
| D. | 导线中通过的电子的物质的量为0.2mol |
分析 连接K后,左侧两个烧杯形成原电池,锌为负极,发生氧化反应,铜为正极,发生还原反应,正极反应为2H++2e-═H2↑,右侧烧杯为电解池,与锌相连接的为阴极,与铜连接的为阳极,总方程式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2 ↑+2H2SO4,加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,以此解答该题.
解答 解:A.Cu活泼性比Zn弱,作正极,正极上氢离子得电子生成氢气,则其电极反应式为2H++2e-═H2↑,锌棒为负极,其电极反应式为Zn-2e-=Zn2+,故A正确;
B.烧杯右侧碳棒与原电池负极相连为阴极,阴极上阳离子得电子,即铜离子得电子析出铜单质,故B正确;
C.右侧烧杯中反应为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2 ↑+2H2SO4,加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,已知Zn-2e-═Zn2+,则溶解的Zn为0.1mol,即6.5g,故C错误;
D.由题目可知,加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,故D正确.
故选C.
点评 本题考查电解原理,为高频考点,把握“加入0.1mol CuO充分反应后,溶液恰好恢复到电解前的状态”发生的电解反应为解答的关键,侧重电极反应、原子守恒及转移电子计算的考查,题目难度中等.

练习册系列答案
相关题目
4.下列表示正确的是( )
| A. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| B. | CO(g)的燃烧热是283.0kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=-566.0kJ•mol-1 | |
| C. | 含有大量AlO2-的溶液中:K+、CO32-、Br-、NH4+可共存 | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有CO32- |
14.下列物质中氧元素的化合价正确的是( )
| A. | H2O中氧元素的化合价为-l | B. | Na2O2中氧元素的化合价为-2 | ||
| C. | NaOH中氧元素的化合价为-1 | D. | Na2O中氧元素的化合价为-2 |
1.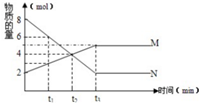 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | t3时,正反应速率大于逆反应速率 | |
| B. | t2时,正逆反应速率相等,反应达到平衡状态 | |
| C. | 化学方程式为:2M=N | |
| D. | t1时,N的浓度是M浓度的2倍 |
18.下列说法正确的是( )


| A. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)缩合,最多可形成4种二肽 | |
| B. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| C. | 实验室用如图装置证明酸性:醋酸>碳酸>苯酚,①中放入浓醋酸,②中放入CaCO3,③中放入C6H5ONa溶液 | |
| D. | 实验室用如图装置证明乙炔具有还原性,①中放入H2O,②中放入电石,③中放入KMnO4溶液 |
6.常温下,向浓HNO3中加入下列物质,反应最快、现象最明显的是( )
| A. | Al | B. | Cu | C. | Fe | D. | C |

 ,请回答下列问题.
,请回答下列问题. .
.