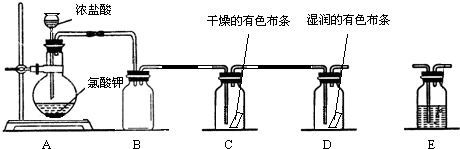
题目内容
10.若NA表示阿佛加德罗常数,下列说法正确的是( )| A. | 1 mol Cl2作为氧化剂得到的电子数为NA | |
| B. | 在25℃,101kPa时,22.4L氢气中含有2NA个氢原子 | |
| C. | 14g氮气中含有7NA个电子 | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
分析 A、Cl2作为氧化剂被还原为Cl-;
B、根据n=计算出氢气的物质的量并结合H2的分子组成来计算;
C、根据氮气的物质的量并结合氮气中的电子个数来计算;
D、根据m=n•M来计算.
解答 解:A、Cl2作为氧化剂被还原为Cl-,故1 mol Cl2得2mol电子,即2NA个,故A错误;
B、在0℃、101 kPa时,气体摩尔体积为22.4L/mol,22.4 L氢气的物质的量n==1mol,含有的氢原子数为2NA个,但是在25℃,101kPa时,结论不成立,故B错误;
C、14 g氮气的物质的量n===0.5mol,而N2中有14个电子,故0.5molN2中含有的电子数N=0.5×14×NA=7NA,故C正确;
D、NA个一氧化碳分子的物质的量n==1mol,质量m1=n•M=1mol×28g/mol=28g;0.5 mol甲烷的质量m2=n•M=0.5 mol×16g/mol=8g,故质量之比为7:2,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用是解题关键,难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
11.关于反应3NO2+H2O═2HNO3+NO的说法正确的是( )
| A. | 该反应的氧化剂是水 | |
| B. | 该反应的还原剂是水 | |
| C. | 氧化剂和还原剂的物质的量比为1:2 | |
| D. | 若有3molNO2反应,则转移电子4mol |
12.下列说法不正确的是( )
| A. | 标准状况下,11.2LCO2的质量为22g | |
| B. | 0.1molCl2与足量水反应转移电子0.2mol | |
| C. | 18gH2O含有的原子总数为3×6.02×1023 | |
| D. | 0.5mol/L Na2SO3溶液中Na+的物质的量浓度为1.0 mol/L |
9.实验室制备Al(OH)3最好用( )
| A. | Al和水 | B. | Al2O3和水 | C. | Al2(SO4)3和KOH | D. | AlCl3和氨水 |
5.下列四个选项是在不同的情况下对化学反应3A(g)+B(g)?2C(g)+2D(g)测得的用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是( )
| A. | v(D)=0.5mol•L-1.s-1 | B. | v(C)=3.0 mol•L-1•min-1 | ||
| C. | v(B)=0.30 mol•L-1.s-1 | D. | v(A)=0.60 mol•L-1.s-1 |
15.下列关于同系物说法中正确的是( )
| A. | 符合同一通式的物质一定属于同系物 | |
| B. | 同系物的碳元素的质量分数一定相等 | |
| C. | 随碳原子数增加,烷烃的熔沸点逐渐升高 | |
| D. | 乙醇和HOCH2CH2CH2OH是同系物 |
2.下列有机物的命名正确的是( )
| A. |  2-乙基丙烷 | B. | 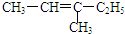 3-甲基-3-戊烯 | C. | 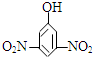 2,4-二硝基苯酚 | D. | 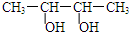 2,3-丁二醇 |
20.镀锌自来水管与下列水龙头连接,连接处自来水管锈蚀最快的是( )
| A. | 铜制水龙头 | B. | 铁制水龙头 | C. | 塑料水龙头 | D. | 陶瓷水龙头 |