题目内容
已知:氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①向其中加入适量的NaBiO3,溶液变为紫红色。②继续滴加适量H2O2,紫红色褪去,并有气泡产生。③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式:________________________________________。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________________。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是
________________________________________________________________________。
(4)若实验②放出了336 mL气体(标准状况),则反应①被氧化的Mn(NO3)2为________ mol。
(1)5BiO3-+2Mn2++14H+=5Bi3++2MnO4-+7H2O
(2)PbO2>KMnO4>H2O2
(3)紫红色褪去,生成(白色)沉淀
(4)0.006
解析

某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系图所示。
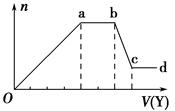
(1)若Y是盐酸,则Oa段转化为沉淀的离子(指来源于X溶液的,下同)是 ,
ab段发生反应的离子是 ,bc段发生反应的离子方程式为 。
(2)若Y是NaOH溶液,则X中一定含有的离子是 ,ab段反应的离子方程式为 。
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
__________KIO3+__________KI+__________H2SO4=__________K2SO4+__________I2+__________H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是__________;
②b中反应所产生的I2的物质的量是__________mol。
化合物A、B是中学常见的物质,其阴阳离子只能从下表中选择:
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
| 阴离子 | OH-、NO3—、I-、HCO3—、AlO2—、HSO4— |
(1)若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①B的化学式为________________。
②A、B溶液混合加热反应的离子方程式为________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A的化学式为____________________。
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示):
i________________________________;ii_______________________________,
③请用一简易方法证明上述溶液变黄的原因:________。
④利用溶液变黄原理,将其设计成原电池,若电子由a流向b(a、b均为石墨电极),则b极的电极反应式为____________________。
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ,加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是_______________________。
(2)将MnO4—氧化Fe2+的离子方程式补充完整:
1MnO4—+Fe2++________===1Mn2++Fe3++________
(3)已知:
生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释步骤Ⅱ的目的:________________________。
(4)已知:一定条件下,MnO4—可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是____________________________。
④Ⅳ中加入MnSO4的目的是__________________________。
正三价铁元素有一定的氧化性,FeCl3溶液吸收一定量SO2后溶液颜色发生变化。
(1)反应的离子方程式为_________________________________________________。
(2)除H+,OH-,H2O外,溶液中一定含有的微粒有________。
| A.Fe2+ | B.Fe3+ | C.Cl- | D.SO42— E.H2SO3 |
假设1:只存在Fe3+;
假设2:只存在______________________________________________________;
假设3:_____________________________________________________________。
(4)设计实验方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂:3 mol·L-1H2SO4,1 mol·L-1NaOH,0.01 mol·L-1KMnO4,
20%KSCN,3%H2O2,淀粉KI溶液、紫色石蕊试液、品红溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
