题目内容
正三价铁元素有一定的氧化性,FeCl3溶液吸收一定量SO2后溶液颜色发生变化。
(1)反应的离子方程式为_________________________________________________。
(2)除H+,OH-,H2O外,溶液中一定含有的微粒有________。
| A.Fe2+ | B.Fe3+ | C.Cl- | D.SO42— E.H2SO3 |
假设1:只存在Fe3+;
假设2:只存在______________________________________________________;
假设3:_____________________________________________________________。
(4)设计实验方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂:3 mol·L-1H2SO4,1 mol·L-1NaOH,0.01 mol·L-1KMnO4,
20%KSCN,3%H2O2,淀粉KI溶液、紫色石蕊试液、品红溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
(1)2Fe3++SO2+2H2O=2Fe2++4H++SO42—
(2)ACD
(3)H2SO3 既不存在Fe3+,也不存在H2SO3
(4)实验步骤 预期现象和结论 步骤1:取少量溶液于试管A中,滴加2~3滴20%KSCN溶液 (1)若溶液变血红色,则假设1成立
(2)若溶液不变血红色,则假设2或3成立步骤2:另取少量溶液于试管B中,滴加2~3滴品红溶液 (1)若溶液红色褪去,则假设2成立
(2)若溶液呈红色,结合步骤1中(2),则假设3成立
或实验步骤 预期现象和结论 步骤1:取少量溶液于试管A中,滴加2~3滴淀粉KI溶液 (1)若溶液变蓝色,则假设1成立
(2)若溶液不变蓝色,则假设2或3成立步骤2:另取少量溶液于试管B中,滴加2~3滴品红溶液 (1)若溶液红色褪去,则假设2成立
(2)若溶液呈红色,结合步骤1中(2),则假设3成立
解析

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是
Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+)。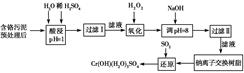
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 11.1 | 8 | 9(>9溶液) |
(1)酸浸时,为了提高浸取率可采取的措施为________________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+,下同)。
(3)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是________。
(4)试配平反应方程式:

 ;
;生成1 mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
Ⅰ.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为 。
其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命。以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 。
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为:2Al+3Ag2O+2NaOH+3H2O 2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
,正极附近溶液的pH (填“变大”、“不变”或“变小”)。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。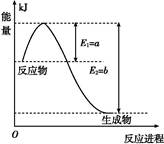
(1)如图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 |
| C.使用催化剂 | D.降低温度 |
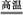 6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
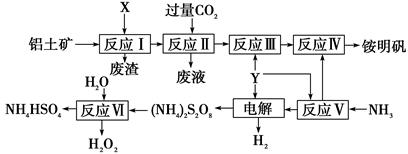
硅孔雀石是一种含铜的矿石,含铜形态为
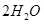 ,同时含有
,同时含有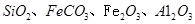 等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图: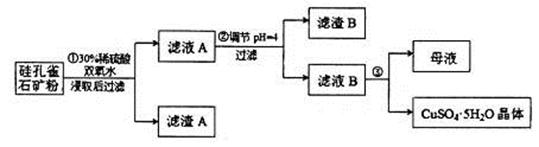
请回答下列问题:
(1)完成步骤①中稀硫酸与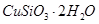 发生反应的化学方程式
发生反应的化学方程式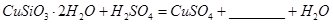 ;
;
用离子方程式表示双氧水的作用_____________________________。
(2)步骤②调节溶液pH选用的最佳试剂是__________________
A.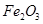 | B.CuO | C.A12O3 | D.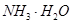 |
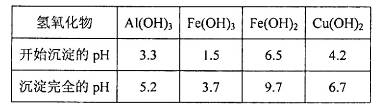
由上表可知:当溶液pH=4时,可以完全除去的离子是______,不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到
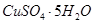 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,
晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,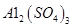 饱和溶液中
饱和溶液中 mol
mol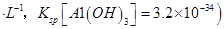 ______________。
______________。(5)若要测定硫酸铜晶体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙、_________________。实验过程中硫酸铜晶体加热失水后在空中冷却后称量,则测定结果______________(填“偏高”、 “偏低”或“不变”)。
 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解