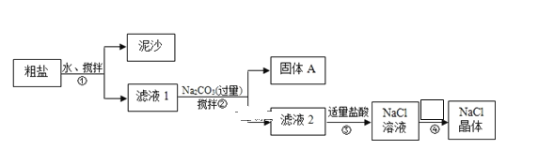
题目内容
【题目】一定条件下,在恒压绝热容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
A. 达到化学平衡状态时,v正(O2)=2v逆(SO2)
B. 容器内的压强不再变化说明反应达到化学平衡状态
C. 加入0.2 mol SO2和0.1 mol O2,充分反应后放出热量19.7kJ
D. 向容器中充入二氧化硫,正反应速率增大,逆反应速率减小
【答案】D
【解析】
A.在任何情况下用不同物质表示反应速率时,速率之比等于化学方程式计量数之比,达到化学平衡状态时,2v正(O2)=v逆(SO2),说明二氧化硫正、逆反应速率相同,反应达到平衡状态,但v正(O2)=2v逆(SO2)说明正、逆反应速率不相同,反应正向进行,不能据此判断反应为平衡状态,A错误;
B.反应前后气体体积变化,反应在恒压绝热容器中进行,压强始终不变,因此不能说明反应达到 化学平衡状态,B错误;
C.反应为可逆反应,反应物不能完全转化为生成物,所以加入0.2 mol SO2和0.1 mol O2,反应达到平衡状态时,充分反应后放出热量小于19.7 kJ,C错误;
D.向恒压绝热容器中充入二氧化硫,正反应速率增大,体积增大后会使逆反应速率会减小,D正确;
故合理选项是D。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】按要求书写
(1)氨气的电子式:___________,乙炔的结构简式:_____________;
(2)工业上利用乙烯催化水化法制取乙醇,化学反应方程式:_____________反应类型:____________;
(3)苯与浓硝酸在50~60℃下发生硝化反应:__________,反应类型:_____________;
(4)已知键能如下:
化学键 | H-H | N-N | N-H | N |
键能/kJ·mol-1 | 432 | 247 | 389 | 942 |
写出N2和H2合成NH3的热化学方程式:______。