题目内容
某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g,FeCl2 0.425mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
| A.100mL的盐酸中HCl物质的量浓度为7.5mol/L |
| B.生成的H2S气体在标准状况下的体积为2.24L |
| C.该磁黄铁矿中FexS的x=0.85 |
| D.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3:1 |
C
试题分析:根据题给信息知,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应,生成FeCl2 0.425mol,根据氯原子守恒知,HCl的物质的量为0.85mol,100mL的盐酸中HCl物质的量浓度为8.5mol/L;根据铁原子守恒知,磁黄铁矿中铁的物质的量为0.425mol,硫单质是由反应2Fe3++S2—===2Fe2++S生成的,生成硫单质2.4g,物质的量为0.075mol,则磁黄铁矿中+3价铁的物质的量为0.15mol,+2价铁的物质的量为0.275mol,根据化合价规则知,原磁黄铁矿中—2价硫的物质的量为0.5mol,根据硫原子守恒知,生成H2S的物质的量为0.425mol,标准状况下的体积为9.52L。A、100mL的盐酸中HCl物质的量浓度为8.5mol/L,错误;B、生成的H2S气体在标准状况下的体积为9.52L,错误;C、该磁黄铁矿中FexS的x=0.85,正确;D、该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为17:6,错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。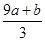 ) mol
) mol