题目内容
a mol FeS与b mol FeO投入V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体,
所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g ②(a+b)×189 g
③(a+b) mol ④(cV-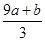 ) mol
) mol
所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g ②(a+b)×189 g
③(a+b) mol ④(cV-
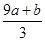 ) mol
) mol| A.①④ | B.②③ | C.①③ | D.②④ |
D
涉及氧化还原反应的知识往往是多种守恒原理的综合运用。本题综合运用原子守恒与电子得失守恒来求解。从题中叙述可知,该反应的产物主要有三种:Fe(NO3)3、H2SO4和NO,其中Fe(NO3)3中硝酸根离子的物质的量等于未被还原的硝酸的物质的量,由原子守恒得出生成的Fe(NO3)3的物质的量为(a+b) mol,则未被还原的硝酸的物质的量为3(a+b) mol,再乘以硝酸的摩尔质量可得出②是正确的。该反应中生成的NO是还原产物,a mol FeS被氧化失去9a mol电子,b mol FeO被氧化失去b mol电子,由得失电子守恒可知生成NO的物质的量为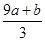 mol,再结合原子守恒可得出④是正确的。
mol,再结合原子守恒可得出④是正确的。
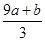 mol,再结合原子守恒可得出④是正确的。
mol,再结合原子守恒可得出④是正确的。
练习册系列答案
相关题目

