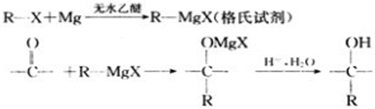
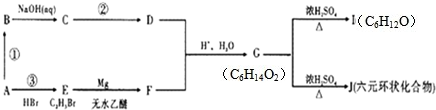
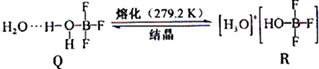
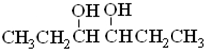题目内容
9.有两种金属混合物4.0g,完全溶解于足量稀硫酸后放出氢气2.24L(标准状况),则此混合物可能的组成是( )| A. | Cu和Mg | B. | Al和Fe | C. | Zn和Fe | D. | Al和Mg |
分析 假设金属都为+2价,根据电子转移计算金属物质的量,再根据M=$\frac{m}{n}$计算金属混合物的平均相对原子质量,利用平均值法对各选项进行判断,注意Al为+3价金属,转化成+2价时相对分子质量为:$\frac{27}{3}$×2=18,若金属不与稀硫酸反应,可以看作相对原子质量为无穷大.
解答 解:标准状况下2.24L氢气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.1mol,则金属混合物的平均相对原子质量为:$\frac{4}{0.1}$=40,
A.Mg的相对原子量为24,Cu不与稀硫酸反应,可以认为其相对原子质量为无穷大,40介于24~无穷大之间,故A正确;
B.Al为+3价金属,转化成+2价时相对分子质量为:$\frac{27}{3}$×2=18,Fe的相对原子质量为56,二者平均相对原子质量可以为40,故B正确;
C.Fe的相对原子质量为56,Zn的相对原子质量为65,二者平均相对原子质量介于56~65之间,不可能为40,故C错误;
D.Al为+3价金属,转化成+2价时相对分子质量为:$\frac{27}{3}$×2=18,Mg的相对原子质量为24,二者平均相对原子质量一定小于40,故D错误;
故选AB.
点评 本题考查混合物的计算,题目难度中等,注意利用平均相对分子质量进行解答,注意明确化合价与相对原子质量的转化方法.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
19.下列反应中,硝酸只表现氧化性的是( )
| A. | Zn+HNO3(稀)→ | B. | Mg(OH)2+HNO3(稀)→ | C. | C+HNO3(浓)→ | D. | Cu+HNO3(浓)→ |
17.下列描述,正确的是( )
| A. | 沸点由高到低顺序排列为新戊烷>异戊烷>正戊烷 | |
| B. | FeCl3溶液可以把5种无色溶液:乙醇、苯酚、AgNO3溶液、KOH溶液,氢硫酸一一区分 | |
| C. | 光照下2,2-二甲基丙烷与Br2反应其二溴取代物有两种 | |
| D. | 分子量为104的烃可能是芳香烃,也可能发生加聚反应,但分子中不可能都是单键 |
14.既可以用来鉴别乙烷与乙烯,又可以用来除去乙烷中乙烯方法是( )
| A. | 通过足量的NaOH溶液 | B. | 通过足量的酸性KMnO4溶液 | ||
| C. | 在Ni催化、加热条件下通入H2 | D. | 通过足量的溴水 |