题目内容
4.卤代烃在醚类溶剂中与Mg反应可制得格氏试剂,格氏试剂在有机合成方面用途广泛.设R为烃基,已知: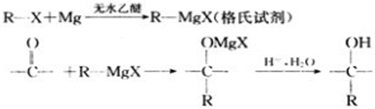
某有机物A有如下转化关系:
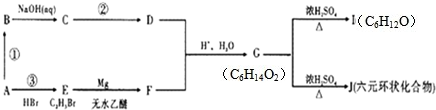
试回答下列问题:
(1)C的名称是乙二醇;G的结构简式是
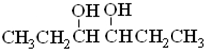
(2)A--F中所有原子可能在同一平面的是CH2=CH2、OHC-CHO(填结构式),为了使产物纯净,反应①中除A外的反应物及溶剂是Br2/CCl4(填化学式)
(3)C→D的化学方程式为HOCH2CH2OH+O2$→_{△}^{催化剂}$OHC-CHO+2H2O;反应类型为氧化反应;G→I的反应方程式为CH3CH2CH(OH)CH(0H)CH2CH3$→_{△}^{浓硫酸}$CH3CH2CH(OH)CH=CHCH3+H2O;反应类型是消去反应
(4)D与F在相同条件下反应,可得到除G外的另一种物质K.则K的化学式为C4H8O2;与K互为同分异构体、属于酯的分子的结构简式为HCOOCH2CH2CH3、HCOOCH(CH3)2或CH3COOCH2CH3或CH3CH2COOCH3.
分析 A与HBr发生加成反应生成E(C2H5Br),则A为CH2=CH2,E为CH3CH2Br,由反应信息可知F为CH3CH2-MgBr;D与F发生信息中反应生成G,由G的分子式及反应信息,可知1分子D与2分子E反应得到G,故D为OHC-CHO,则G为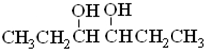 ,C为HOCH2CH2OH,故反应①可以是乙烯与溴发生加成反应生成B为BrCH2CH2Br,B发生水解反应生成C,由I分子与G分子相差1个水分子,应是G发生消去反应脱去1分子水生成I,故I为CH3CH2CH(OH)CH=CHCH3等,2分子G脱去2分子水形成六元环醚J,据此解答.
,C为HOCH2CH2OH,故反应①可以是乙烯与溴发生加成反应生成B为BrCH2CH2Br,B发生水解反应生成C,由I分子与G分子相差1个水分子,应是G发生消去反应脱去1分子水生成I,故I为CH3CH2CH(OH)CH=CHCH3等,2分子G脱去2分子水形成六元环醚J,据此解答.
解答 解:A与HBr发生加成反应生成E(C2H5Br),则A为CH2=CH2,E为CH3CH2Br,由反应信息可知F为CH3CH2-MgBr;D与F发生信息中反应生成G,由G的分子式及反应信息,可知1分子D与2分子E反应得到G,故D为OHC-CHO,则G为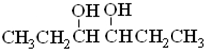 ,C为HOCH2CH2OH,故反应①可以是乙烯与溴发生加成反应生成B为BrCH2CH2Br,B发生水解反应生成C,由I分子与G分子相差1个水分子,应是G发生消去反应脱去1分子水生成I,故I为CH3CH2CH(OH)CH=CHCH3等,2分子G脱去2分子水形成六元环醚J,
,C为HOCH2CH2OH,故反应①可以是乙烯与溴发生加成反应生成B为BrCH2CH2Br,B发生水解反应生成C,由I分子与G分子相差1个水分子,应是G发生消去反应脱去1分子水生成I,故I为CH3CH2CH(OH)CH=CHCH3等,2分子G脱去2分子水形成六元环醚J,
(1)C为HOCH2CH2OH,C的名称是乙二醇;G的结构简式是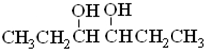 ,
,
故答案为:乙二醇;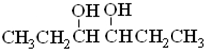 ;
;
(2)A为CH2=CH2,为平面结构,所有原子处于同一平面,B为BrCH2CH2Br、C为HOCH2CH2OH、E为CH3CH2Br、F为CH3CH2-MgBr、G为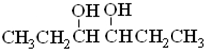 ,G发生消去反应生成I,六者均存在甲基的四面体结构,所有原子不可能处于同一平面,D为OHC-CHO,存在-CHO为平面结构,2个平面通过旋转碳碳单键可以处于同一平面,所有原子可能处于同一平面;
,G发生消去反应生成I,六者均存在甲基的四面体结构,所有原子不可能处于同一平面,D为OHC-CHO,存在-CHO为平面结构,2个平面通过旋转碳碳单键可以处于同一平面,所有原子可能处于同一平面;
为了使产物纯净,反应①中除A外的反应物及溶剂是:Br2/CCl4,
故答案为:CH2=CH2、OHC-CHO;Br2/CCl4;
(3)C→D的化学反应方程式为:HOCH2CH2OH+O2$→_{△}^{催化剂}$OHC-CHO+2H2O,属于氧化反应;
G生成I反应方程式为CH3CH2CH(OH)CH(0H)CH2CH3$→_{△}^{浓硫酸}$CH3CH2CH(OH)CH=CHCH3+H2O,
该反应是消去反应,
故答案为:HOCH2CH2OH+O2$→_{△}^{催化剂}$OHC-CHO+2H2O;氧化反应;CH3CH2CH(OH)CH(0H)CH2CH3$→_{△}^{浓硫酸}$CH3CH2CH(OH)CH=CHCH3+H2O;消去反应;
(4)D与F在相同条件下反应,可得到除G外的另一种物质K,则K的化学式为C4H8O2;与K互为同分异构体、属于酯的分子的结构简式为HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3COOCH2CH3或CH3CH2COOCH3,
故答案为:C4H8O2;HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3COOCH2CH3或CH3CH2COOCH3.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力及知识迁移能力,以E为突破口采用正逆结合的方法、结合题给信息进行推断,正确推断各物质结构简式是解本题关键,难点是同分异构体种类判断.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| A. | 碳原子与碳原子之间形成的σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 乙炔分子中,共含有4个σ键,1个π键 | |
| D. | 共价单键都属于σ键,π键只存在于双键或叁键中 |
| A. | 64n | B. | $\frac{1}{64}$n | C. | 32n | D. | $\frac{3}{64}$n |
| A. | AgNO3溶液、KOH溶液、K2SO3溶液、KI溶液 | |
| B. | 苯酚溶液、CCl4溶液、氯水、氨水 | |
| C. | 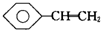 、CH3-C≡CH、福尔马林、乙醛 、CH3-C≡CH、福尔马林、乙醛 | |
| D. | NaOH溶液、FeCl2溶液、亚硫酸溶液、KCl溶液 |
| A. | 丙烯、环丙烷 | B. | 甲醛、甲酸甲酯 | ||
| C. | 对甲基苯酚、苯甲醇 | D. | 乳酸、葡萄糖 |
| A. | Cu和Mg | B. | Al和Fe | C. | Zn和Fe | D. | Al和Mg |
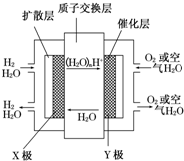 中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”--质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”--质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )| A. | 工作时“X极”周围溶液的酸性增强 | |
| B. | 氢气在电极上发生还原反应 | |
| C. | 图中标出的“Y极”实际是原电池的负极 | |
| D. | 工作过程中,质子(H+)从“Y极”一边透过质子交换膜移动到“X极”一边与OH-反应生成水 |
| 步骤 | 实验过程 | 实验用品 |
| Ⅰ | 将干海带灼烧灰化 |  |
| Ⅱ | 将海带灰溶解、过滤 |  和①玻璃棒(玻璃仪器名称) |
| Ⅲ | 氧化滤液中的I-,反应的离子方程式为②2I-+H2O2+2H+=I2+2H2O |  |
| Ⅳ | 取少量Ⅲ中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到③下层溶液变为紫红色,说明海带中含有碘元素. |  |
V分别取5mL 1mol/L NaBr溶液于两支小试管中
Ⅵ向两支试管中分别滴加5滴新制氯水,溶液均变为黄色
ⅥⅠ向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色
ⅥⅡ…
④请写出步骤VI中反应的离子方程式Cl2+2Br-=Br2+2Cl-;为验证溴的氧化性强于碘,步骤VIII的操作和现象是:将VI所得黄色溶液滴入II所得滤液中,溶液变为黄色,再加入淀粉溶液,溶液变为蓝色.
⑤步骤ⅥⅠ的目的是确认VI所得黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰.
⑥氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,电子层数依次增大,则原子半径逐渐增大,得电子能力逐渐减弱,非金属性减弱.
 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: