题目内容
在10L密闭容器中,A、B、C三种气态物质构成可逆反应体系,其关系如图所示。下列说法错误的是
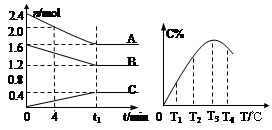
A.0~4分钟时,A的平均反应速率为0.01mol·L-1·min-1
B.由T1向T2变化时,V正>V逆
C. 此反应的正反 应为吸热反应
D.其它条件不变,加压,达新平衡时,C的体积分数增大
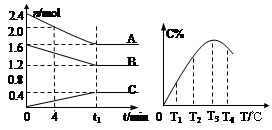
A.0~4分钟时,A的平均反应速率为0.01mol·L-1·min-1
B.由T1向T2变化时,V正>V逆
C. 此反应的正反 应为吸热反应
D.其它条件不变,加压,达新平衡时,C的体积分数增大
C
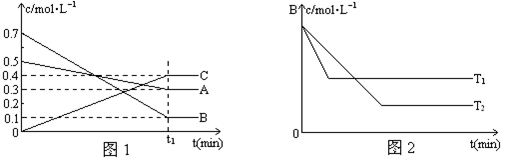
试题分析:0~4分钟时,A的平均反应速率为(2.4-2.0)/10/4=0.01mol·L-1·min-1 ,故A正确;由右边的图可以知道,温度升高,随着反应的进行,C的百分含量逐渐增加,当到达T3时,达到平衡,故由T1向T2变化时,V正>V逆,故B正确,当达到平衡时,增加温度C的百分含量减少,所以该反应为放热反应,故C错误,为本题的正确答案;由左边的图可以看出在反应达到平衡是消耗了0.8mol的A,0.4mol的B,生成了0.4mol的C,所以可以得到以下方程是2A+B=C,所以其它条件不变,加压,达新平衡时,C的体积分数增大,故D正确。

练习册系列答案
相关题目
 2C(g)+2D(g) △H<0。右图中曲线a、b分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措
2C(g)+2D(g) △H<0。右图中曲线a、b分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措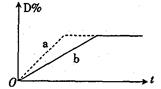
 2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题: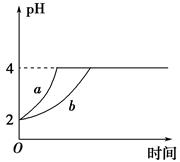
 H2(g) + I2(g),达到 平衡状态的标志是
H2(g) + I2(g),达到 平衡状态的标志是  2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,达到平衡时下列物质的浓度可能为( )
2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,达到平衡时下列物质的浓度可能为( ) 2NH3,下列有关说法正确的是( )
2NH3,下列有关说法正确的是( ) 4NO2(g)+ O2(g)。反应5min后,测得N2O5的物质的量为2mol,求:(要求写详细解题过程)
4NO2(g)+ O2(g)。反应5min后,测得N2O5的物质的量为2mol,求:(要求写详细解题过程)