题目内容
可逆反应3A(g) 3B(?)+C(?)(正反应吸热)达到化学平衡后,
3B(?)+C(?)(正反应吸热)达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量 ;
②若B、C都不是气体,气体的平均相对分子质量 ;
③若B是气体,C不是气体,气体的平均相对分子质量 ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是 态,C是 态。
(3)如果B为气体,C为固体,取3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L。若使反应从逆反应开始,起始时在容器中加入3molB ,同样条件下,要使平衡时B的浓度仍为2.1mol/L,则C的取值范围应该是 。
 3B(?)+C(?)(正反应吸热)达到化学平衡后,
3B(?)+C(?)(正反应吸热)达到化学平衡后,(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量 ;
②若B、C都不是气体,气体的平均相对分子质量 ;
③若B是气体,C不是气体,气体的平均相对分子质量 ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是 态,C是 态。
(3)如果B为气体,C为固体,取3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L。若使反应从逆反应开始,起始时在容器中加入3molB ,同样条件下,要使平衡时B的浓度仍为2.1mol/L,则C的取值范围应该是 。
(1)变小 不变 变小 (2)固体或液体 固体或液体或气体 (3) C(C)>0.3mol
试题分析:(1)可逆反应3A(g)
 3B(?)+C(?)(正反应吸热),所以当温度升高,平衡向正反应方向进行,①若B、C都是气体,则正反应方向为分子数增加的反应,故气体的平均相对分子质量增加;②若B、C都不是气体,则气体就只有A,所以气体的平均相对分子质量不变;③若B是气体,C不是气体,则该反应的气体的分子数不变,但是C为非气体,故气态物质的质量比原理减小了,所以气体的平均相对分子质量变小;(2)如果平衡后保持温度不变,将容器体积增加一倍,此时A的浓度必须为原来的50%,但是达到新平衡时A的浓度是原来的60%,说明了反应向逆反应方向移动,所以B为固体或液体,而C可以为 固体或液体或气体;(3)B为气体,C为固体,说明了只要C足量,压强对该反应是没有影响的,3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L,则消耗的A为2.1mol,剩下0.9molA,而使反应从逆反应开始,起始时在容器中加入3molB ,同样条件下,要使平衡时B的浓度仍为2.1mol/L,即B为2.1mol,要生产0.9molA,需要0.3molC,所以C的物质的量要大于0.3mol。
3B(?)+C(?)(正反应吸热),所以当温度升高,平衡向正反应方向进行,①若B、C都是气体,则正反应方向为分子数增加的反应,故气体的平均相对分子质量增加;②若B、C都不是气体,则气体就只有A,所以气体的平均相对分子质量不变;③若B是气体,C不是气体,则该反应的气体的分子数不变,但是C为非气体,故气态物质的质量比原理减小了,所以气体的平均相对分子质量变小;(2)如果平衡后保持温度不变,将容器体积增加一倍,此时A的浓度必须为原来的50%,但是达到新平衡时A的浓度是原来的60%,说明了反应向逆反应方向移动,所以B为固体或液体,而C可以为 固体或液体或气体;(3)B为气体,C为固体,说明了只要C足量,压强对该反应是没有影响的,3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L,则消耗的A为2.1mol,剩下0.9molA,而使反应从逆反应开始,起始时在容器中加入3molB ,同样条件下,要使平衡时B的浓度仍为2.1mol/L,即B为2.1mol,要生产0.9molA,需要0.3molC,所以C的物质的量要大于0.3mol。点评:本题考查了影响化学平衡的因素,该考点是高考考查的重点和难点,本题综合性好,对学生的分析能量要求比较高,该题有一定的难度。

练习册系列答案
相关题目
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)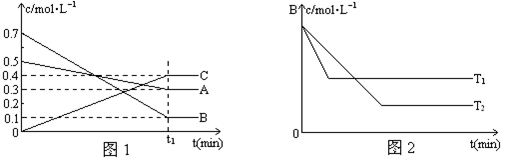
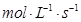 与用物质Y表示的化学反应速率为0.1
与用物质Y表示的化学反应速率为0.1 2HI(g)达到平衡时的标志是( )
2HI(g)达到平衡时的标志是( ) zC(g) △H<0。
zC(g) △H<0。 2C(g)+2D(g) △H<0。右图中曲线a、b分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措
2C(g)+2D(g) △H<0。右图中曲线a、b分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措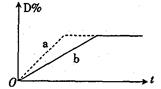
 2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。 2NH3,下列有关说法正确的是( )
2NH3,下列有关说法正确的是( )