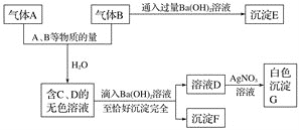
题目内容
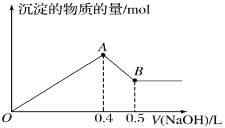
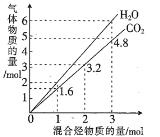
【题目】(1)两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示。则该产物混合气体的平均摩尔质量为___________g· mol-1(保留3位有效数字),该混合烃的平均分子式为________________。
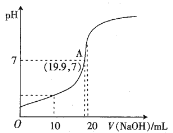
(2)常温下,向20 mL 0.10 mol·L-1HB溶液中逐滴滴入0.10 mol·L-1 NaOH溶液,所得pH曲线如下图所示。则HB是_______酸(填“强”或“弱”),A点对应的溶液中![]() 为_______。
为_______。
【答案】29.6 C1.6H4 弱 199
【解析】
(1)根据图像,当混合烃的物质的量为1mol时,生成1.6molCO2、2molH2O,据此分析解答;
(2)根据图像,向20 mL 0.10 mol·L-1HB溶液中逐滴滴入0.10 mol·L-1 NaOH溶液,当滴入20 mLNaOH溶液时,恰好反应生成盐,此时溶液的pH>7,据此判断;A点对应的溶液的pH=7,根据加入的氢氧化钠和剩余的HB计算c(B-)= c(Na+)和c(HB),在计算![]() 。
。
(1)根据图像,当混合烃的物质的量为1mol时,生成1.6molCO2、2molH2O,二氧化碳和水蒸气的物质的量之比为1.6mol∶2mol=4∶5,因此该产物混合气体的平均摩尔质量为![]() =29.6;1.6molCO2、2molH2O中含有1.6molC和4molH,因此混合烃的平均化学式为C1.6H4,故答案为:29.6;C1.6H4;
=29.6;1.6molCO2、2molH2O中含有1.6molC和4molH,因此混合烃的平均化学式为C1.6H4,故答案为:29.6;C1.6H4;
(2)根据图像,向20 mL 0.10 mol·L-1HB溶液中逐滴滴入0.10 mol·L-1 NaOH溶液,当滴入20 mLNaOH溶液时,恰好反应生成盐,此时溶液的pH>7,显碱性,说明HB为弱酸;A点对应的溶液的pH=7,c(B-)= c(Na+)=![]() mol/L,c(HB)=
mol/L,c(HB)= ![]() mol/L,因此
mol/L,因此![]() =
=![]() =199,故答案为:弱;199。
=199,故答案为:弱;199。