��Ŀ����
����Ŀ���������йؽ�������ķ�Ӧ������д���пհף�
��1���ֱ�ȡW g�ơ������������������ᷴӦ������ͬ�����²����������������__________��
��2���ֱ�ȡ0.1 mol�ơ������������������ᷴӦ������ͬ�����²����������������_________��
��3����������ͬ���ʵ����������������ơ�����������������___________________��
��4����������ͬ�����ͬ��ͬѹ���������������ơ������������ʵ���֮����_______________��
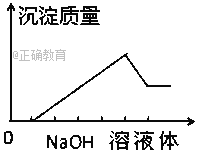
��5���ֱ�ȡ0.2 mol�Ľ����ơ��������ֱ�Ͷ��10 mL 1 mol/L�������У�����²�������������ɴ�С��˳����______________��[�ơ���������������������ֱ���V1��V2��V3��ʾ]
���𰸡�1/23:1/28:1/9 1:2:3 23:28:9 6:3:2 V1>V2=V3
��������
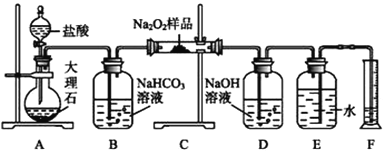
���ݽ����ơ��������Ļ�ѧ���ʷ�����𣻸������ʵ�����ؼ���������
(1)���ݷ���ʽ�� 2Na+2HCl��2NaCl+H2����Fe+2HCl��FeCl2+H2����2Al+6HCl��2AlCl3+3H2�������������ʵ���Ϊ��n(Na)=![]() mol��n (Fe)=
mol��n (Fe)=![]() mol��n(Al)=
mol��n(Al)=![]() mol���������������ʵ����ֱ�Ϊ��
mol���������������ʵ����ֱ�Ϊ��![]() mol��
mol�� ![]() mol��
mol�� ![]() mol������ͬ�����²��������������Ϊ��
mol������ͬ�����²��������������Ϊ��![]() mol��
mol�� ![]() mol��
mol�� ![]() mol=1/23:1/28:1/9��
mol=1/23:1/28:1/9��
(2)0.1mol�������������ᷴӦ����0.05molH2��0.1molFe�����ᷴӦ����0.1molH2��0.1molAl�����ᷴӦ����0.15molH2��������ͬ�����²��������������Ϊ��0.05:0.1:0.15=1:2:3��
(3) ��������ͬ���ʵ���������������������1mol������ҪNa 2mol��Fe 1mol��Al 2/3mol����������Ϊ��[2mol��23g/mol]:[1mol��56g/mol]:[2/3mol��27g/mol]= 23:28:9��
(4) ��������ͬ�����ͬ��ͬѹ������������Ϊ��ͬ���ʵ���������������Ҫ�ơ������������ʵ���֮����6:3:2���ɲο�(3)��
(5) 2Na+2HCl=2NaCl+H2���� 2Na+2H2O=2NaOH+H2����Fe+2HCl=FeCl2+H2��
2Al+6HCl=2AlCl3+3H2����10ml 1mol/L��������HCl�����ʵ�����0.010mol����������������������������ֽ��������ᷴӦʱ�����ɵ�����������������������Ƶģ�������������ʵ������㣬�����ᷴӦ����H2�����ʵ���Ϊ0.005mol������ͬ���������ڳ��������ƻ�����ˮ��Ӧ�����������������������ɵ����������ǣ�Na>Mg=Al���ʴ�Ϊ��V1>V2=V3��

 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�