题目内容
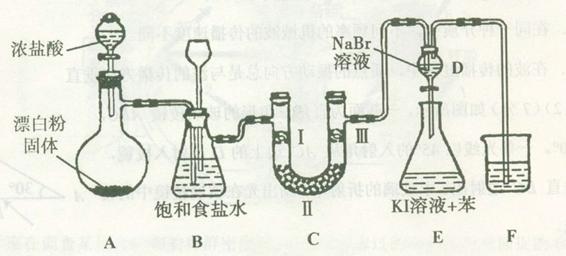
二氧化锰与浓盐酸混合加热得到氯气,如图是制取并探究Cl2化学性质的装置图。

(1)圆底烧瓶中发生反应的化学方程式为 。
(2)若要得到干燥纯净的气体,B、C中应分别盛放的试剂为 、 。
(3)E中若装有FeCl2溶液,反应的离子方程式为 ,E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(4)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象某化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ,实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。

(1)圆底烧瓶中发生反应的化学方程式为 。
(2)若要得到干燥纯净的气体,B、C中应分别盛放的试剂为 、 。
(3)E中若装有FeCl2溶液,反应的离子方程式为 ,E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(4)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象某化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ,实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
(1)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)饱和食盐水 浓硫酸
(3)2Fe2++Cl2=2Fe3++2Cl-
溶液变蓝
(4)①探究c(Cl-)对反应的影响 探究c(H+)对反应的影响 ②c(H+)的大小
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(2)饱和食盐水 浓硫酸
(3)2Fe2++Cl2=2Fe3++2Cl-
溶液变蓝
(4)①探究c(Cl-)对反应的影响 探究c(H+)对反应的影响 ②c(H+)的大小
(1)MnO2与浓盐酸反应的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)用该方法制得的氯气中含有HCl和水蒸气,分别用饱和食盐水和浓硫酸除去。
(3)氯气与FeCl2溶液反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-。氯气将KI氧化为单质碘,单质碘使淀粉变蓝色。
(4)对比a、b、c、d、e五个实验方案可以看出,五个实验中都有MnO2和Cl-,只有a、c、e中有较高浓度的H+,这三个实验产生了Cl2,b、d中有较高浓度的Cl-,但无H+,没有产生Cl2,说明影响氯气生成的原因是H+浓度的大小。实验b的目的是探究c(Cl-)对反应的影响,实验c的目的是探究c(H+)对反应的影响。
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。(2)用该方法制得的氯气中含有HCl和水蒸气,分别用饱和食盐水和浓硫酸除去。
(3)氯气与FeCl2溶液反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-。氯气将KI氧化为单质碘,单质碘使淀粉变蓝色。
(4)对比a、b、c、d、e五个实验方案可以看出,五个实验中都有MnO2和Cl-,只有a、c、e中有较高浓度的H+,这三个实验产生了Cl2,b、d中有较高浓度的Cl-,但无H+,没有产生Cl2,说明影响氯气生成的原因是H+浓度的大小。实验b的目的是探究c(Cl-)对反应的影响,实验c的目的是探究c(H+)对反应的影响。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示). C
C