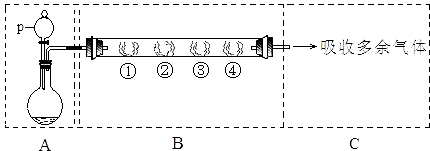
题目内容
5.25℃时,0.1mol/L的盐酸中,由水电离产生的c(H+)为( )| A. | 1×10-1mol/L | B. | 1×10-7mol/L | C. | 1×10-11mol/L | D. | 1×10-13 mol/L |
分析 纯水中c(H+)=c(OH-),Kw=c(H+)×c(OH-),水的离子积常数只与温度有关,与溶液的酸碱性无关,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,据此解答即可.
解答 解:酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,0.1mol/L盐酸溶液中,氢氧根离子浓度=$\frac{1×1{0}^{-14}}{0.1}$=10-13,所以水电离出的氢离子浓度是10-13,
故选D.
点评 本题考查了水的离子积常数的有关计算,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列说法正确的是( )
| A. | 按系统命名法,化合物 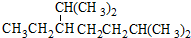 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 符合分子式为C3H4Cl2的所有同分异构体数目为7种 | |
| C. | 丁烷、正戊烷、新戊烷、已烷的沸点依次升高 | |
| D. |  、 、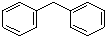 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 |
13.下列有机物命名正确的是( )
| A. | 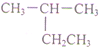 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2OH 1-丁醇 | ||
| C. |  对二甲苯 对二甲苯 | D. | 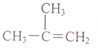 2-甲基-2-丙烯 2-甲基-2-丙烯 |
20.可以区别苯酚、乙醇、氢氧化钠、硝酸银、硫氰化钾五种溶液的一种试剂是( )
| A. | 溴水 | B. | 新制Cu(OH)2 | C. | FeCl3溶液 | D. | 金属钠 |
17.食用下列物质不会引起中毒的是( )
| A. | 用三聚氰胺配制的奶粉 | B. | 加有大量亚硝酸钠(NaNO2)的火腿 | ||
| C. | 用碳酸钡做x射线透视的“钡餐” | D. | 加碘盐(含碘酸钾的食盐) |
14.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| C. | 1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
15.在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )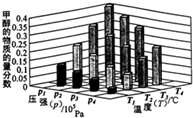

| A. | P3>P2 T3>T2 | B. | P2>P4 T4>T2 | C. | P1>P3 T3>T1 | D. | P1>P4 T2>T3 |