题目内容
5.下列实验能到达预期目的是( )| 实验内容 | 实验目的 | |
| A | 测定同浓度的Na3PO4和Na2SO4水溶液的pH | 探究磷、硫两种元素非金属性的强弱 |
| B | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水溶加热 | 检验蔗糖是否已水解 |
| C | 将乙醇与浓硫酸共热产生气体直接通入酸性kMnO4溶液 | 检验乙烯的生成 |
| D | 向AgCl沉淀中滴加少量KI溶液,观察白色沉淀转化为黄色沉淀 | 验证Ksρ(AgCl)>Ksρ(AgI) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.同温同浓度的Na3PO4和Na2SO4水溶液,前者pH大,则酸性硫酸大于磷酸,以此比较非金属性;
B.蔗糖在酸作用下水解生成葡萄糖和果糖具有还原性在碱性条件下才能被银氨溶液氧化,发生银镜反应;
C.乙醇可与酸性高锰酸钾发生氧化还原反应;
D.沉淀向更难溶的方向转化.
解答 解:A.同温同浓度的Na3PO4和Na2SO4水溶液,前者pH大,则酸性硫酸大于磷酸,则非金属性S>P,故A正确;
B.蔗糖是非还原性糖,在酸作用下水解生成葡萄糖和果糖具有还原性,需要先加入氢氧化钠中和硫酸呈碱性,再加入银氨溶液加热出现银镜现象,证明蔗糖水解,故B错误;
C.乙醇可与酸性高锰酸钾发生氧化还原反应,应先除去乙醇,故C错误;
D.白色沉淀转化为黄色沉淀,说明生成AgI,生成物溶度积更小,则Ksp(AgCl)>Ksp(AgI),故D正确.
故选AD.
点评 本题考查了实验方案评价,明确实验原理是解本题关键,根据物质的性质来分析解答,易错选项是C,注意乙醇子的性质,为易错点,难度中等.

练习册系列答案
相关题目
20.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(2)反应Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O中的氧化剂为Cl2.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-也不存在ClO-
②基于假设3(即验证假设3成立),设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol.L-1H2SO4、1mom.L-1NaOH、0.01mol.L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
(4)研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气,缓慢通过足量氯水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g.则此空气中SO2的浓度为6.4 mg/m3.(只要求计算结果,结果单位用mg/m3表示).
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(2)反应Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O中的氧化剂为Cl2.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-也不存在ClO-
②基于假设3(即验证假设3成立),设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol.L-1H2SO4、1mom.L-1NaOH、0.01mol.L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol.L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | |
| 步骤2:向A试管中滴加1-2滴0.01mol.L-1KMnO4溶液. | 溶液呈浅紫色,则证明不存在SO32-, 则证明不存在SO32-. |
| 步骤3:向B试管中滴加1-2滴淀粉-KI溶液. | 溶液不变蓝色, 则证明不存在ClO-. |
1.已知:CH3(CH2)2CH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2878kJ•mol-1
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
| A. | 正丁烷的燃烧热为-2878kJ•mol-1 | |
| B. | 正丁烷分子所具有的能量大于异丁烷分子 | |
| C. | 等量的异丁烷分子中碳氢键比正丁烷的多 | |
| D. | 异丁烷转化为正丁烷的过程是一个放热过程 |
18.已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
830℃时,向一个5L的密闭容器中充入0.2mol的A和0.8mol的B,下列说法不正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应的△H<0 | |
| B. | 若反应经过一段时间后,达到平衡时A的转化率为80% | |
| C. | 如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.则6s时 n(A)为0.11 mol | |
| D. | c(A)不随时间改变或单位时间里生成c和D的物质的量相等均可作为是否达到平衡的依据 |
5.某有机物的结构简式为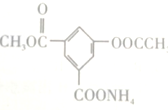 ,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )
,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )
 ,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )
,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |
17.与CH3CH2CH=CH2互为同分异构体的是( )
| A. | 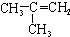 | B. | CH2=CH-CH=CH2 | C. |  | D. | 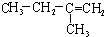 |
14.满足相应条件的下列有机物,同分异构体数目最少的是( )
| 选项 | 分子式 | 结构或性质 |
| A | C5H10 | 能使溴的CCl4溶液褪色 |
| B | C7H7Br | 含甲基和苯环 |
| C | C5H12O | 能与Na反应生成H2 |
| D | C5H10O2 | 能与碳酸氢钠反应生成CO2 |
| A. | A | B. | B | C. | C | D. | D |
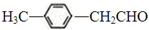 转化为对甲基苯乙炔
转化为对甲基苯乙炔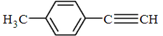 的合成路线流程图如下:
的合成路线流程图如下: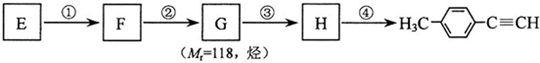
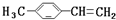 ,③的反应类型为加成反应.
,③的反应类型为加成反应. .
.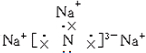 ;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.
;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.