题目内容
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量约为60 g
C.1 mol偏二甲肼的质量为60 g·mol-1
D.6 g偏二甲肼含有NA个偏二甲肼分子
【答案】B
【解析】
A.偏二甲肼的摩尔质量应为60 g·mol-1,A中单位不对,故A错误;
B.6.02×1023个偏二甲肼约为1 mol,其质量约为60 g,故B正确;
C.质量的单位为g,1 mol偏二甲肼的质量为60 g,故C错误;
D.6 g C2H8N2的物质的量为n=![]() =0.1 mol,含有C2H8N2分子应为0.1NA,故D错误。
=0.1 mol,含有C2H8N2分子应为0.1NA,故D错误。
答案:B。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
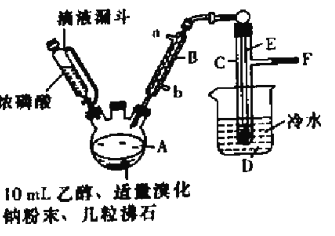
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置),反应原理为:H3PO4(浓)+NaBr![]() +NaH2PO4+HBr,CH3CH2OH+HBr
+NaH2PO4+HBr,CH3CH2OH+HBr![]() CH3CH2Br+H2O, 有关数据见下表:
CH3CH2Br+H2O, 有关数据见下表:
物质名称 | 乙醇 | 溴乙烷 | 溴 |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/gcm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中加入沸石的作用是______________________.
(2)仪器B的名称为____________,该仪器的进水口为_______(填“a”或“b”)口.
(3)实验中用滴液漏斗代替分液漏斗的优点为_________________
(4)制取氢溴酸时,为什么不能用浓H2SO4代替浓磷酸?_________(用化学方程式表示).
(5)将C中的馏出液转入锥形瓶中,边振荡边逐滴滴入浓H2SO4以除去水等杂质,滴加浓硫酸约1~2mL,使溶液明显分层,再用分液漏斗分去硫酸层,将经硫酸处理后的溴乙烷转入蒸馏瓶,水浴加热蒸馏,收集到35~40℃馏分约10.0g,从乙醇的角度考虑,本实验所得溴乙烷的产率是______(保留三位有效数字)