题目内容
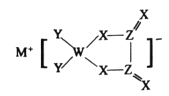
【题目】M、W、X、Y、Z是同周期主族元素,X原子的最外层电子数是W原子次外层电子数的3倍。它们形成的化合物可用作新型电池的电极材料,结构如图所示,化合物中除![]() 外其它原子均满足8电子稳定结构。下列说法正确的是
外其它原子均满足8电子稳定结构。下列说法正确的是
A.M的单质通常保存在煤油中B.W的最高价氧化物对应的水化物是一元弱酸
C.简单气态氢化物稳定性X>YD.上述五种元素中Z的电负性最大
【答案】B
【解析】
M、W、X、Y、Z是同周期主族元素, X的最外层电子数是W次外层电子数的3倍, W有两个电子层,次外层为2个电子, X为O元素,由盐的结构可知,Z可以形成四个共价键,且能与氧形成双键,因此Z的最外层电子数为4 ,Z为C元素;四种元素位于同周期,且Y能形成一个共价键,Y为F元素; W能形成4个共价键,W为B元素;新型电池材料,除M外均满足8电子稳定结构,M形成+1价离子,M为Li元素;故M为Li元素, X为O元素, Y为F元素,Z为C元素,W为B元素。
A.M为Li元素,Li单质密度比煤油小,不可以保存在煤油中,一般保存在石蜡油中,A错误;
B.W为B元素,W的最高价氧化物对应的水化物为H3BO3为一元弱酸,B正确;
C.同周期元素非金属性从左到右依次增大,所以非金属性F>O,非金属性越强,气态氢化物的稳定性越强,故稳定性HF>H2O,C错误;
D.同周期从左到右元素的电负性逐渐增大,上述五种元素中,F的电负性最大,D错误;
故选B。

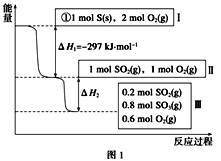
【题目】![]() 资源化利用的方法之一是合成二甲醚(
资源化利用的方法之一是合成二甲醚(![]() 简写做
简写做![]() )。
)。![]() 催化加氢法合成
催化加氢法合成![]() ,其过程中主要发生下列反应:
,其过程中主要发生下列反应:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
其中,反应Ⅱ分以下两步完成,请写出反应Ⅳ的热化学方程式。
反应Ⅲ:![]()
![]()
反应Ⅳ:___________。
⑴反应Ⅳ的热化学方程式为________。
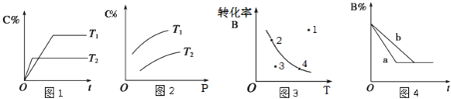
⑵在![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 的平衡转化率和平衡时
的平衡转化率和平衡时![]() 、
、![]() 的选择性随压强或温度的变化见下图。已知:
的选择性随压强或温度的变化见下图。已知:
![]() 的选择性
的选择性![]() ;
;
![]() 的选择性
的选择性![]()
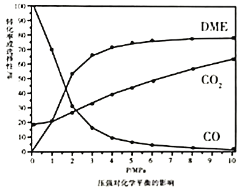
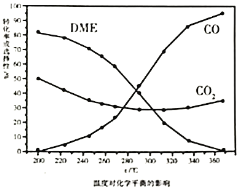
①依据图像中的数据分析,提高平衡时![]() 的选择性应当选择的条件为________。
的选择性应当选择的条件为________。
A 高温高压 B 低温低压 C 高温低压 D 低温高压
按照温度对化学平衡的影响图像分析温度低于300℃,![]() 平衡转化率随温度升高而降低的原因是_______。
平衡转化率随温度升高而降低的原因是_______。
②某温度和压强下,起始投入![]() 与足量
与足量![]() 发生反应,达到平衡时
发生反应,达到平衡时![]() 的转化率为40%,部分物质的物质的量如下表:
的转化率为40%,部分物质的物质的量如下表:
|
|
|
|
|
|
计算平衡时![]() 的选择性为________,反应Ⅳ的化学平衡常数为________。
的选择性为________,反应Ⅳ的化学平衡常数为________。
⑶经研究发现,在不同反应条件下反应相同时间(未平衡)测定发现,体系中![]() 的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
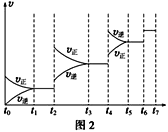
⑷![]() ,投料比为
,投料比为![]() 时进行反应,
时进行反应,![]() 的浓度随时间变化如下图所示,则下列说法正确的为________。
的浓度随时间变化如下图所示,则下列说法正确的为________。
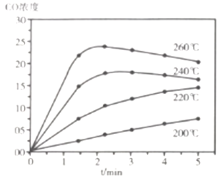
A 在![]() 范围内,反应Ⅰ的速率随温度升高而增大
范围内,反应Ⅰ的速率随温度升高而增大
B 200℃条件下,随反应时间的延长,![]() 的浓度始终增大
的浓度始终增大
C 260℃条件下,随反应时间的延长,![]() 的浓度先增大后减小最终不变
的浓度先增大后减小最终不变
D 260℃条件下,![]() 后
后![]() 的浓度减小是因为随时间推移反应Ⅱ的进行使体系中
的浓度减小是因为随时间推移反应Ⅱ的进行使体系中![]() 浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使
浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使![]() 浓度逐渐下降
浓度逐渐下降