��Ŀ����
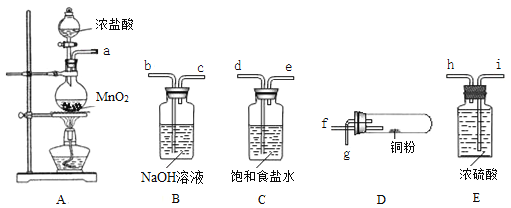
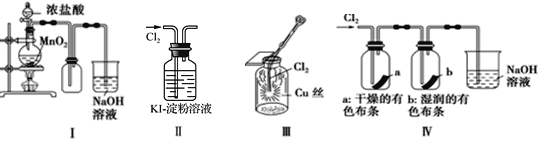
����Ŀ��ijС������ͼ��ʾװ�ö�Cl2��Na2S2O3��Һ�ķ�Ӧ����̽�����������Ѽ��飩��
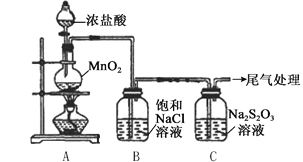
ʵ�����������
���� | ���� |
��Һ©���������μ�һ����Ũ���ᣬ���� | i. A���л���ɫ�������ɣ�C��Һ���Ϸ��а�������Һ�п�ʼ�����������ǣ� ii. һ��ʱ���C�в���������ɫ������ |
��ʪ��ĵ��۵⻯����ֽ����C�а��� | ���۵⻯����ֽ���� |
C����Һ���˺�ȡ������Һ�������ữ���μ��Ȼ�����Һ | �а�ɫ�������� |
�������ϣ�a. S2O32-�н�ǿ�Ļ�ԭ��
b. ����������S2O32-Ѹ�ٷֽ�ΪS��SO2
��1��A�з�����Ӧ�����ӷ���ʽ��__________��
��2��B�б���NaCl��Һ��������_______��
��3��C�����ɻ�ɫ���������ӷ���ʽ��__________��
��4��Ϊ����C���Ƿ���SO2���ɣ�����еIJ�����_______��
��5��C����Һ���Ȼ�����Һ��Ӧ���ɰ�ɫ��������ͬѧ��Ϊ���ø������֤��Na2S2O3��Cl2��������Ӧ�����ӷ���ʽ��__________��
��6����ͬѧ��Ϊ��C����Һ�������ữ��μ���������Һ�����а�ɫ������Ҳ��֤��Na2S2O3��Cl2��������ͬѧ��Ϊ����֤����������__________��
���𰸡� MnO2+4H++2Cl-![]() Mn2++C12��+2H2O ��ȥCl2�е�HCl����ֹ��Cl2��Na2S2O3�ķ�Ӧ�������� S2O32-+2H+��S+SO2��+H2O �Ѱ���ͨ��Ba��NO3��2��Һ�У����а�ɫ������֤����SO2���� S2O32-+4Cl2+5H2O��8Cl-+2SO42-+10H+ ������ˮ��ӦҲ������Cl-�����Լ������Һ����Cl-Ҳ����֤����Cl2������Na2S2O3
Mn2++C12��+2H2O ��ȥCl2�е�HCl����ֹ��Cl2��Na2S2O3�ķ�Ӧ�������� S2O32-+2H+��S+SO2��+H2O �Ѱ���ͨ��Ba��NO3��2��Һ�У����а�ɫ������֤����SO2���� S2O32-+4Cl2+5H2O��8Cl-+2SO42-+10H+ ������ˮ��ӦҲ������Cl-�����Լ������Һ����Cl-Ҳ����֤����Cl2������Na2S2O3
�������������������1��A�ж������̺�Ũ�����ڼ���������Ӧ���ɶ��Ȼ��̡�������ˮ��������Ӧ�����ӷ���ʽ��MnO2+4H+ +2Cl��![]() Mn2++Cl2 ��+2H2O����2��������Ϣb������������S2O32��Ѹ�ٷֽ�ΪS��SO2֪B�б���NaCl��Һ�������dz�ȥCl2�е�HCl����ֹ��Cl2��Na2S2O3�ķ�Ӧ�������š���3��C�����ɻ�ɫ���������ӷ���ʽ��S2O32�� + 2H+====S�� + SO2 ��+H2O����4��Ϊ����C���Ƿ���SO2���ɣ�������SO2�Ļ�ԭ�Խ��м��飬����еIJ����ǰѰ���ͨ��Ba(NO3)2��Һ�У����а�ɫ������֤����SO2 ���ɡ���5��S2O32���н�ǿ�Ļ�ԭ�ԣ�ˮ��Һ��S2O32����Cl2���������������Cl2����ԭ�������ӣ���Ӧ�����ӷ���ʽ��S2O32�� +4Cl2+5H2O====8Cl��+2SO42-+10H+����6��C����Һ�������ữ��μ���������Һ�����а�ɫ����������֤��Na2S2O3��Cl2������������������ˮ��ӦҲ������Cl�������Լ������Һ����Cl��Ҳ����֤����Cl2������Na2S2O3��
Mn2++Cl2 ��+2H2O����2��������Ϣb������������S2O32��Ѹ�ٷֽ�ΪS��SO2֪B�б���NaCl��Һ�������dz�ȥCl2�е�HCl����ֹ��Cl2��Na2S2O3�ķ�Ӧ�������š���3��C�����ɻ�ɫ���������ӷ���ʽ��S2O32�� + 2H+====S�� + SO2 ��+H2O����4��Ϊ����C���Ƿ���SO2���ɣ�������SO2�Ļ�ԭ�Խ��м��飬����еIJ����ǰѰ���ͨ��Ba(NO3)2��Һ�У����а�ɫ������֤����SO2 ���ɡ���5��S2O32���н�ǿ�Ļ�ԭ�ԣ�ˮ��Һ��S2O32����Cl2���������������Cl2����ԭ�������ӣ���Ӧ�����ӷ���ʽ��S2O32�� +4Cl2+5H2O====8Cl��+2SO42-+10H+����6��C����Һ�������ữ��μ���������Һ�����а�ɫ����������֤��Na2S2O3��Cl2������������������ˮ��ӦҲ������Cl�������Լ������Һ����Cl��Ҳ����֤����Cl2������Na2S2O3��

����Ŀ����֪�±����ݣ�
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp/25 �� | 8.0��10��16 | 2.2��10��20 | 4.0��10��36 |
��ȫ����ʱ��pH��Χ | ��9.6 | ��6.4 | ��3 |
�Ժ������ʵ�����CuSO4��FeSO4��Fe2(SO4)3�Ļ����Һ������˵������ȷ���ǣ� ��
A. ��û����Һ����μ���NaOH��Һ�����ȿ���������ɫ����
B. ����Һ��c(SO42-)��[c(Cu2��)��c(Fe2��)��c(Fe3��)]��5��4
C. �����Һ�м���������ˮ������pH��4��5����ˣ��ɻ�ô�����CuSO4��Һ
D. �����Һ�м���������ˮ������pH��9.6����ˣ������ó������գ��ɵõ����ʵ�����CuO��FeO��Fe2O3���ֹ���Ļ����