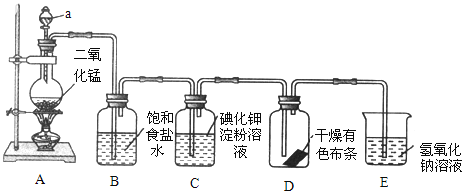
题目内容
【题目】在以稀硫酸为电解质溶液的铜﹣﹣锌原电池中,已知其电极反应分别为锌片:Zn﹣2e﹣=Zn2+;铜片:2H++2e﹣=H2↑.下列判断正确的是( )
A.溶液的酸性逐渐增强
B.铜片逐渐溶解
C.溶液中H+向锌片作定向移动
D.锌片是负极并被氧化
【答案】D
【解析】解:A.铜作正极,正极上氢离子得电子生成氢气,所以溶液中H+的物质的量浓度不断减小,溶液酸性逐渐减弱,故A错误; B.铜为正极,锌为负极,锌逐渐溶解,铜的质量不变,故B错误
C.铜为正极,锌为负极,溶液中H+移向正极铜片,故C错误;
D.锌为负极,锌失去电子发生氧化反应,故D正确;
故选D.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】某学习小组为了探究原电池反应,做了如下实验:将Al片和Zn片插入到Na2SO4溶液中,装置如下图。
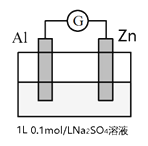
操作 | 现象 |
i接通电流计 | 接通开始之后指针向右偏且稳定;两极附近均没有明显现象。 |
ii向溶液中加入50mL 2mol/L H2SO4 | 开始时指针仍向右偏,Al、Zn表面均产生少量气泡;大约半分钟后,指针向左偏且稳定,Al、Zn表面均产生大量气泡。 |
下列说法不正确的是
A. i中指针向右偏时,Al的电极反应为:O2 + 4e- +2H2O = 4OH-
B. ii中开始时, Zn做负极,SO42-向Zn极移动
C. ii中半分钟后,装置中的反应为Al的析氢腐蚀和Al的化学腐蚀共存
D. 从上述实验中可以得出,Al在H2SO4中的还原性强于在Na2SO4中
【题目】某小组用下图所示装置对Cl2与Na2S2O3溶液的反应进行探究(气密性已检验)。
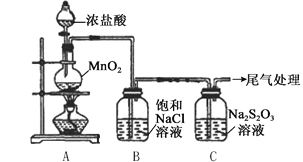
实验操作和现象:
操作 | 现象 |
打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i. A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii. 一段时间后,C中产生大量黄色沉淀。 |
用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查阅资料:a. S2O32-有较强的还原性
b. 酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是__________。
(2)B中饱和NaCl溶液的作用是_______。
(3)C中生成黄色沉淀的离子方程式是__________。
(4)为检验C中是否有SO2生成,需进行的操作是_______。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是__________。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是__________。