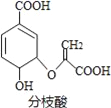
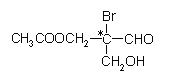题目内容
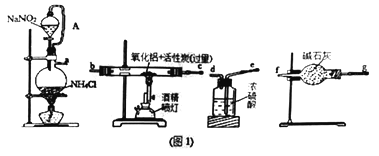
【题目】某研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计如图1所示实验装置。
请回答:
(1)图1中用饱和NaNO2溶液与NH4Cl溶液加热制取氮气,该离子方程式为____________________。
(2)按要求连接好实验装置后,接下来首先进行的操作是______________________________。
(3)导管A的作用是_______________________________。
(4)图1装置中各仪器导管口连接的顺序是(可重复使用,用小写字母a→f填写):____
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。
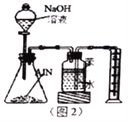
①氮化铝与过量的NaOH溶液反应生成氮气化学反应方程式为__________________________。
②集气瓶中的苯的作用是_________________________;集气瓶中的液体没有装满,则实验测得NH3的体积将___________________________(填“偏大”“偏 小”或“不变”)。
③若实验中称取氮化铝样品的质量为8.2g,测得氨气的体积2.8L(标准状况),则样品中AlN的质量分数为____________________(保留3位有效数字)
【答案】 NO2-+NH4+![]() 2H2O+N2↑ 检查装置的气密性 平衡分液漏斗与烧瓶之间的压强,使NaNO2饱和溶液顺利滴下 a-e-d-g-f-c-b(或b-c) -g-f AlN+NaOH+H2O===NaAlO2+NH3↑ 防止氨气溶于水 不变 62.5%
2H2O+N2↑ 检查装置的气密性 平衡分液漏斗与烧瓶之间的压强,使NaNO2饱和溶液顺利滴下 a-e-d-g-f-c-b(或b-c) -g-f AlN+NaOH+H2O===NaAlO2+NH3↑ 防止氨气溶于水 不变 62.5%
【解析】(1)图1中用饱和NaNO2溶液与NH4Cl溶液加热制取氮气,化学方程式为:NaNO2+NH4Cl![]() NaCl+2H2O+N2↑,反应的离子方程式为NO2-+NH4+
NaCl+2H2O+N2↑,反应的离子方程式为NO2-+NH4+![]() 2H2O+N2↑,故答案为:NO2-+NH4+
2H2O+N2↑,故答案为:NO2-+NH4+![]() 2H2O+N2↑;
2H2O+N2↑;
(2)有气体的实验装置要检查装置气密性;故答案为:检查装置的气密性;
(3)导管A的作用是平衡分液漏斗与烧瓶之间的压强,使NaNO2饱和溶液顺利滴下,故答案为:平衡分液漏斗与烧瓶之间的压强,使NaNO2饱和溶液顺利滴下;
(4)用饱和NaNO2溶液与NH4Cl溶液加热制取氮气与氧化铝反应,因氮化铝易水解,故流程中应注意无水,则氮气从a经浓硫酸干燥,为干燥充分,导管长进短出,连接e、d,为干燥充分,可再连接一个干燥管,gf,在玻璃管中反应,故连接bc,为防止空气中的水蒸气进入装置,最后连接一个干燥管gf,故答案为:a-e-d-g-c(或b)c(或b)-g-f或a-e-d-g-f--b(或c)-c(或b)-g-f;
(5)①氮化铝与过量的NaOH溶液反应生成氨气化学反应方程式为:AlN+NaOH+H2O═NaAlO2+NH3↑;故答案为:AlN+NaOH+H2O═NaAlO2+NH3↑;
②因为氨气极易溶于水,所以广口瓶的水面上应加一层苯,来将气体和水隔绝,广口瓶中的气压之所以会增大,是因为有氨气进入,所以无论广口瓶中是否有空气,进入瓶中氨气的体积都等于排进量筒中水的体积,所以不受影响;故答案为:防止氨气溶于水;不变;
③氨气的体积为2.8L(标准状况),则n(氨气)= ![]() =0.125mol,所以氮化铝的物质的量是0.125mol,质量是0.125mol×41g/mol=5.125g,所以氮化铝的质量分数为
=0.125mol,所以氮化铝的物质的量是0.125mol,质量是0.125mol×41g/mol=5.125g,所以氮化铝的质量分数为![]() ×100%=62.5%;故答案为:62.5%。
×100%=62.5%;故答案为:62.5%。

 阅读快车系列答案
阅读快车系列答案【题目】某小组用下图所示装置对Cl2与Na2S2O3溶液的反应进行探究(气密性已检验)。
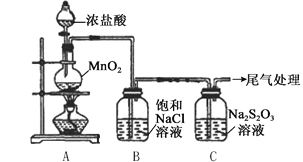
实验操作和现象:
操作 | 现象 |
打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i. A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii. 一段时间后,C中产生大量黄色沉淀。 |
用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查阅资料:a. S2O32-有较强的还原性
b. 酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是__________。
(2)B中饱和NaCl溶液的作用是_______。
(3)C中生成黄色沉淀的离子方程式是__________。
(4)为检验C中是否有SO2生成,需进行的操作是_______。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是__________。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是__________。