题目内容
Cu-Zn稀硫酸组成原电池装置,当导线中有0.5mol电子通过时,理论上两极的变化是( )
①锌极反应:Zn-2e-=Zn2+,锌片上产生0.25mol的H2
②铜极反应:2H++2e-=H2↑,锌片溶解16.25g
③电流由铜极经导线流向锌极
④溶液中SO42-移向铜极.
①锌极反应:Zn-2e-=Zn2+,锌片上产生0.25mol的H2
②铜极反应:2H++2e-=H2↑,锌片溶解16.25g
③电流由铜极经导线流向锌极
④溶液中SO42-移向铜极.
| A、①④ | B、③④ | C、②③ | D、①③ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:铜锌原电池中,Zn易失电子作负极,电极反应为Zn-2e-=Zn2+,Cu作正极,电极反应2H++2e-=H2↑,电流从正极流向负极,电解质溶液中阴离子向负极移动、阳离子向正极移动,再根据锌、氢气和转移电子之间的关系式计算.
解答:
解:①锌易失电子作负极,锌极反应:Zn-2e-=Zn2+,铜电极上生成氢气,故错误;
②铜极反应:2H++2e-=H2↑,锌片溶解质量=
×65g/mol=16.25g,故正确;
③放电时,电流从正极流向负极,所以电流由铜极经导线流向锌极,故正确;
④溶液中SO42-移向负极锌极,氢离子移向正极铜极,故错误;
故选C.
②铜极反应:2H++2e-=H2↑,锌片溶解质量=
| 0.5mol |
| 2 |
③放电时,电流从正极流向负极,所以电流由铜极经导线流向锌极,故正确;
④溶液中SO42-移向负极锌极,氢离子移向正极铜极,故错误;
故选C.
点评:本题考查了原电池原理,根据失电子难易程度确定正负极,知道正负极上发生的反应,注意电解质溶液中离子移动方向,为易错点.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
已知某无色溶液只由Fe3+、Mg2+、Cu2+、Al3+、NH4+、Cl-、OH-中的几种组成,向此溶液中加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.继续加入淡黄色粉末时,产生无刺激性气味的气体,白色沉淀只能部分溶解,则此溶液中一定大量含有的离子( )
| A、Mg2+、Al3+、NH4+、Cl- |
| B、Mg2+、Al3+、NH4+、Fe3+ |
| C、Mg2+、Cu2+、NH4+、OH- |
| D、Mg2+、Cu2+、NH4+、Cl- |
下列离子方程式正确的是( )
| A、过量铁屑溶于少量稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| B、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H20+CO2↑ |
| C、用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ |
| D、钢铁发生吸氧腐蚀的正极反应:O2+4e-+4H+═2H2O |
某溶液中由水电离产生的c(H+)=10-10mol?L-1,则该溶液中的溶质不可能是( )
| A、H2SO4 |
| B、NaOH |
| C、FeCl3 |
| D、KHSO4 |
下列说法正确的是( )
| A、互为手性的分子具有相似的性质,故生产药物时不必分离 |
| B、NF3分子立体构型为三角锥形,是极性分子 |
| C、N2O和CO2互为等电子体所以化学性质相似 |
| D、酸性:HClO>HClO2>HClO3>HClO4 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、5.6g铁和6.4g铜分别与0.1mol氯气完全反应,转移的电子数相等 |
| B、0.5mol O3与11.2L O2所含的分子数一定相等 |
| C、等质量的14NO和13CO气体中含有的中子数相等 |
| D、常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
1.1mol氯气跟白磷完全反应生成三氯化磷和五氯化磷,其物质的量比为2:1,则生成物中五氯化磷的物质的量为( )
| A、0.4mol |
| B、0.1mol |
| C、0.2mol |
| D、0.05mol |
绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是( )
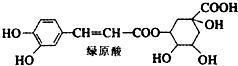

| A、绿原酸能使酸性KMnO4溶液褪色 |
| B、绿原酸水解产物均可以与FeCl3溶液发生显色反应 |
| C、1mol绿原酸与足量溴水反应,最多消耗2.5mol Br2 |
| D、1mol绿原酸与足量NaOH溶液反应,最多消耗8mol NaOH |
