题目内容
7.某学习小组拟对 KMnO4 与 Na2S 的反应进行了探究.所有探宄实验中所使用的 KMnO4 溶液均为浓酸酸化的 0.1mol/LKMnO4 溶液[c(H+)=1.5mol/L].| 实验 | 操作 | 现象 |
| a | 向2mL 0.1mol/LNa2S溶液中滴加3滴KMnO4溶液, 振荡,静置 | 溶液中出现黄色浑浊,得到淡黄色沉淀、无色溶液 |
| b | 向2mL 1.0mol/LNa2S溶液中滴加3滴KMnO4溶液, 振荡,静置 | 溶液中出现黄色浑浊,浑浊消失,得到浅黄色溶液 |
| c | 向2mL 2.4mol/LNa2S溶液中滴加3滴KMnO4溶液, 振荡,静置 | 有肉红色固体生成,上清液为 浅黄色 |
| d | 向 2mL KMnO4 溶液中滴加 0.1mol/L Na2S 溶液 | 立即有臭鸡蛋气味气体生成,稍后,有棕褐色固体生成 |
| e | 取少量d中所得固体,滴加 1.0mol/L Na2S 溶液,振荡,静置 | 得到黑色固体,浅黄色溶液 |
Ⅰ.Na2SX 可溶于水,Na2SX 在酸性条件下不稳定.
II.MnS 为肉红色固体,难溶于水.
(1)请写出实验 a 中 Na2S 与 KMnO4 发生的化学反应方程式5Na2S+2KMnO4+8H2SO4=5S↓+2MnSO4+8H2O+K2SO4+5Na2SO4.
(2)针对实验 b 中,静置后淡黄色沉淀溶解的原因,小组同学提出两种假设:
假设 i:淡黄色沉淀溶于水中;
假设 ii:淡黄色沉淀与 Na2S 反应得到 Na2SX 并溶解.
①小组同学仔细分析实验过程后,认为假设 i 不成立,其依据为:实验a与实验b所得到S的质量、溶液体积均相同,而a中S未溶解.
②小组同学通过进一步实验证实溶液中存在 Na2SX.请用化学用语说明设计该实验所依据的化学原理:Sx2-+2H+═H2S↑+(x-1)S↓
(3)请结合平衡移动原理,解释实验 abc 中,仅 c 得到肉红色固体的原因:溶液中存在平衡MnS(s)?Mn2+(aq)+S2-(aq),实验c中c(S2-)明显高于实验a、b中c(S2-),促使化学平衡向逆反应方向移动,得到肉红色固体.
(4)为探究实验 d 中所得棕褐色固体的组成,小组同学继续进行了实验 e.某同学分析后,认为黑色固体为纯净的某种物质,并设计实验证实了他的猜想.其实验操作为:取少量黑色沉淀于试管中,加入2mL3%H2O2溶液,观察是否有无色气体放出(或取少量黑色沉淀于试管中,加入4mL浓盐酸,加热,观察有无黄绿色气体生成).
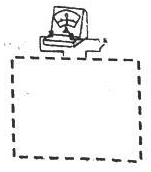 (5)实验d中,两溶液混合后立即发生的复分解反应可能干扰氧化还原反应的进行,请设计实验,在排除上述干扰的前提下探究等体积的 KMnO4 溶液与 0.1mol/L Na2S 溶液反应的可能的还原产物.(已知:该条件 KMnO4 可反应完全).(请将实验装置补充充整,标出所用试剂,并描述实验操作)
(5)实验d中,两溶液混合后立即发生的复分解反应可能干扰氧化还原反应的进行,请设计实验,在排除上述干扰的前提下探究等体积的 KMnO4 溶液与 0.1mol/L Na2S 溶液反应的可能的还原产物.(已知:该条件 KMnO4 可反应完全).(请将实验装置补充充整,标出所用试剂,并描述实验操作) 如
 图组装好装置,闭合开关K,(发现指针偏转.)待指针归零后,观察右管内有无沉淀生成.若有,则还原产物包含MnO2.用胶头滴管吸取U型管右管内上清液1mL于试管中,加入过量2.4mol/LNa2S溶液,若有肉红色固体生成,则还原产物还包含Mn2+
图组装好装置,闭合开关K,(发现指针偏转.)待指针归零后,观察右管内有无沉淀生成.若有,则还原产物包含MnO2.用胶头滴管吸取U型管右管内上清液1mL于试管中,加入过量2.4mol/LNa2S溶液,若有肉红色固体生成,则还原产物还包含Mn2+(6)综合以上实验,KMnO4 酸性溶液与 Na2S 溶液反应的复杂性,与溶液的pH值或反应物的相对用量有关.
分析 (1)根据实验 a的现象和资料Ⅱ可知Na2S 与 KMnO4 发生反应生成单质硫和Mn2+;
(2)①根据实验 a的现象,又根据实验b的现象,在相同体积不同浓度的Na2S溶液中滴加相同的KMnO4溶液可分析出假设 i 不成立的依据;
②根据Na2SX和酸反应产生淡黄色沉淀和臭鸡蛋气味的气体的性质的实验所证实;
(3)溶液中存在平衡 MnS(s)?Mn 2+(aq)+S 2-(aq),增大生成物浓度平衡逆向移动,产生更多的MnS沉淀;
(4)根据黑色固体为纯净的某种物质,猜想为MnO2,再根据MnO2的性质设计实验;
(5)两溶液混合后立即发生反应,闭合开关 K,若发现指针偏转,证明是发生氧化还原反应,待指针归零后,观察右管内若有沉淀生成.则还原产物包含 MnO 2.若无沉淀,用胶头滴管吸取 U 型管右管内上清液 1 mL 于试管中,加入过量 2.4 mol/L Na 2S 溶液,若有肉红色固体生成,则还原产物还包含 Mn2+.
(6)Na2S 溶液与酸性溶液反应产生硫化氢气体.
解答 解:(1)由实验a的现象:“出现黄色浑浊,得到淡黄色沉淀、无色溶液”,又知MnS 为肉红色固体,难溶于水,推知Na2S 与 KMnO4 发生反应生成单质硫和Mn2+,反应
方程式:5Na2S+2KMnO4+8H2SO4=5S↓+2MnSO4+8H2O+K2SO4+5Na2SO4,
故答案为:5Na2S+2KMnO4+8H2SO4=5S↓+2MnSO4+8H2O+K2SO4+5Na2SO4;
(2)①根据实验 a的现象溶液中出现黄色浑浊,得到淡黄色沉淀,又根据实验b的现象溶液中出现黄色浑浊,浑浊消失,得到浅黄色溶液,在相同体积不同浓度的Na2S溶液中滴加相同的KMnO4溶液可分析出假设 i 不成立的依据是实验 a 与实验 b 所得到 S 的质量、溶液体积均相同,而 a 中 S 未溶解,
故答案为:实验 a 与实验 b 所得到 S 的质量、溶液体积均相同,而 a 中 S 未溶解;
②Na2SX和酸反应产生淡黄色沉淀和臭鸡蛋气味的气体的方程式:Sx2-+2H+═H2 S↑+(x-1)S↓,
故答案为:Sx2-+2H+═H2 S↑+(x-1)S↓;
(3)溶液中存在平衡 MnS(s)?Mn 2+(aq)+S 2-(aq),增大S2-浓度平衡逆向移动,产生更多的MnS沉淀,实验 c 中 c(S 2-)明显高于实验 a、b中 c(S 2-),
故答案为:溶液中存在平衡 MnS(s)?Mn 2+(aq)+S 2-(aq),实验 c 中 c(S 2-)明显高于实验 a、b中 c(S 2-),促使化学平衡向逆反应方向移动,得到肉红色固体.
(4)MnO2为黑色固体,根据MnO2的性质设计实验为:取少量黑色沉淀于试管中,加入 2 mL 3%H2O2 溶液,观察是否有无色气体放出.(或取少量黑色沉淀于试管中,加入 4 mL 浓盐酸,加热,观察有无黄绿色气体生成),
故答案为:取少量黑色沉淀于试管中,加入 2 mL 3% H2 O 2溶液,观察是否有无色气体放出.(或取少量黑色沉淀于试管中,加入 4 mL 浓盐酸,加热,观察有无黄绿色气体生成);
(5)如右图组装好装置,两溶液混合后立即发生反应,闭合开关 K,若发现指针偏转,证明是发生氧化还原反应,待指针归零后,观察右管内若有沉淀生成.则还原产物包含 MnO 2.若无沉淀,用胶头滴管吸取 U 型管右管内上清液 1 mL 于试管中,加入过量 2.4 mol/L Na 2S 溶液,若有肉红色固体生成,则还原产物还包含 Mn2+.
故答案为:如 图组装好装置,闭合开关 K,(发现指针偏转.)待指针归零后,观察右管内有无沉淀生成.若有,则还原产物包含 MnO 2.用胶头滴管吸取 U 型管右管内上清液 1 mL 于试管中,加入过量 2.4 mol/L Na 2S 溶液,若有肉红色固体生成,则还原产物还包含 Mn2+;
图组装好装置,闭合开关 K,(发现指针偏转.)待指针归零后,观察右管内有无沉淀生成.若有,则还原产物包含 MnO 2.用胶头滴管吸取 U 型管右管内上清液 1 mL 于试管中,加入过量 2.4 mol/L Na 2S 溶液,若有肉红色固体生成,则还原产物还包含 Mn2+;
(6)Na2S 溶液与酸性溶液反应产生硫化氢气体,KMnO4 酸性溶液与 Na2S 溶液反应与溶液的 pH 值或反应物的相对用量有关.
故答案为:溶液的 pH 值或反应物的相对用量.
点评 本题考查了实验方案设计,充分考查了学生的分析、理解能力及灵活应用化学知识的能力,(6)注意反应物用量对反应的影响,为易错点,题目难度中等.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案| A. | 单质分子中均含共价键 | |
| B. | 由不同元素组成的多原子分子里,只存在极性键 | |
| C. | HF与HBr相比,分子内共价键更强,所以HF沸点更高 | |
| D. | 硫酸氢钠溶于水既有离子键被破坏又有共价键被破坏 |
| A. | 0.05mol/(L•s) | B. | 0.1mol/(L•s) | C. | 0.2mol/(L•s) | D. | 0.8mol/(L•s) |
| A. | 向一定量的AgNO3溶液中加入氨水至沉淀消失 | |
| B. | 向一定量的AlCl3中滴加NaOH直到沉淀消失 | |
| C. | 向一定量的CuSO4溶液中加入氨水至沉淀消失 | |
| D. | 向FeCl3溶液中加入KSCN溶液 |
| A. | 元素b的简单气态氢化物的热稳定性比e的弱 | |
| B. | 元素c的最高价氧化物对应水化物的碱性比d的强 | |
| C. | 简单离子半径r:c>d>e>b | |
| D. | 元素a、b、e各自最高和最低化合价的代数和分别为0、4、4 |
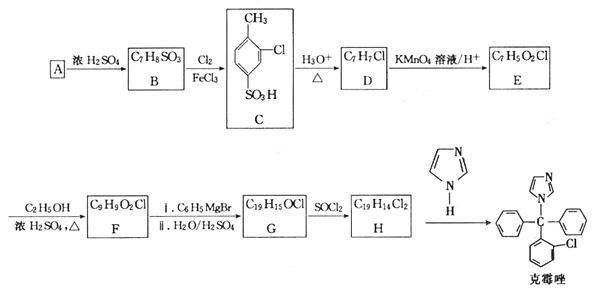

 .
. +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl.
+HCl. 、
、 .
. 的合成路线.
的合成路线. 4-甲基-3-乙基-2-己烯;
4-甲基-3-乙基-2-己烯;  2,2,3-三甲基戊烷;
2,2,3-三甲基戊烷; 1,4-二乙基苯.
1,4-二乙基苯. .
. 已知某粒子的结构示意图如图.试回答:
已知某粒子的结构示意图如图.试回答: 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: