题目内容
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有_________、___________。
Ⅱ.测定中和热的实验装置如下图所示。
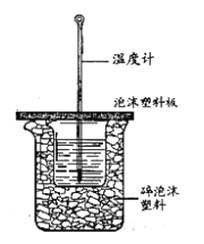
(3)大小烧杯之间填满碎泡沫塑料的作用是________,从实验装置上看,图中缺少的一种玻璃仪器________。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____℃ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②通过计算可得中和热△H=___________(精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是____。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_________(填“偏大”、“偏小”、“不受影响”)。
【答案】5.0 250mL 容量瓶 胶头滴管 保温、隔热、减少实验过程中的热量损失 环形玻璃搅拌棒或环形玻璃搅拌器 3.4 —56.8kJ/mol A、C、D 不相等 相等 偏小
【解析】
Ⅰ.(1)若实验中大约要使用245 mL NaOH溶液,由于与该体积最接近的容量瓶是250mL,因此至少需要称量NaOH固体是(0.50 mol/L×0.25L)×40g/mol=5.0g;
(2)配制物质的量浓度的溶液过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有250ml容量瓶、胶头滴管;
Ⅱ.(3)大小烧杯之间填满碎泡沫塑料的作用是保温、隔热、减少实验过程中的热量损失;从实验装置上看,图中缺少的一种玻璃仪器环形玻璃搅拌棒或环形玻璃搅拌器;
(4)①四组实验的温度差值是:3.4℃、6.1℃、3.3℃、3. 5℃,可见第二次实验数据偏差太大,应该舍去,平均温度是:(3.4℃+3.3℃+3. 5℃)÷3=3.4℃;
②反应过程中放出的热量Q=c·m·Δt=4.18J/(mol·g·℃)×100g×3.4℃×10-3 kJ/J=1.421KJ,n(H+)= 0.05L×0.25mol/L×2=0.025mol;n(OH-)=0.05L×0.55 mol/L=0.02750 mol>0.025mol,所以发生中和反应的物质的量应该以不足量的酸为标准,中和热△H=![]() = -56.8kJ/mol;
= -56.8kJ/mol;
③A.实验装置保温、隔热效果差,使热量部分散失,导致中和热偏低,正确;
B.量取NaOH溶液的体积时仰视读数,则NaOH的物质的量偏多,使热量产生的多,则中和热偏多,错误;
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,则在测量过程中热量会部分散失,导致中和热偏低,正确;
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,则在测量酸时就一部分反应放出,使热量部分散失,导致中和热偏低,正确。因此选项是A、C、D;
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,则n(H+)= 0.06L×0.25mol/L×2=0.003mol>0.02750 mol,所以放出的热量应该以酸为标准;由于反应的物质增多,所以与上述实验相比,所放出的热量就不相等;但是所求中和热由于是产生1mol的水时放出的热量,因此不会发生变化;若用50 mL 0.50 mol/L醋酸代替H2SO4溶液进行上述实验,由于醋酸是弱酸,电离需要吸收热量,因此发生酸碱中和反应放出的热量就少,则测得反应前后温度的变化值会减小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案