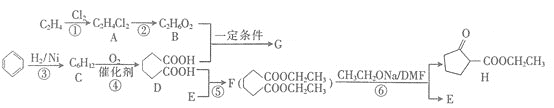
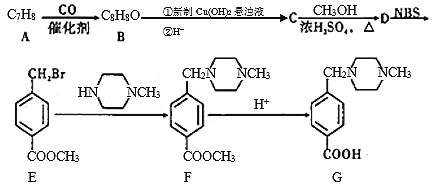
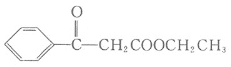题目内容
【题目】下面的排序不正确的是( )
A.晶体熔点高低:对羟基苯甲醛>邻羟基苯甲醛
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
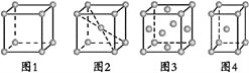
D.硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为MgB2
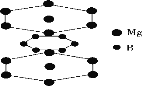
【答案】C
【解析】
A.由于对羟基苯甲醛能形成分子间氢键,熔点升高,而邻羟基苯甲醛易形成分子内氢键,故对羟基苯甲醛的熔点高于邻羟基苯甲醛,故A正确;
B. 金刚石、碳化硅、晶体硅均为原子晶体,其硬度与晶体中共价键的键长有关,一般键长越短,硬度越大,三者的键长是:C-C<C-Si <Si-Si,故硬度是金刚石>碳化硅>晶体硅,B正确;
C. Na、Mg、Al均属于金属晶体,其熔点与金属离子半径和金属离子所带的电荷成正比,离子半径是:r(Na+)>r(Mg2+)>r(Al3+),所带电荷是Na+<Mg2+<Al3+,故熔点是:Na<Mg<Al,故C错误;
D.由晶胞图可知,Mg位于六棱柱的12个顶点和上下底面心中,故一个晶胞中Mg的数目为:![]() ,而六个硼原子均位于晶胞的体内,故一个晶胞中的硼原子个数为:
,而六个硼原子均位于晶胞的体内,故一个晶胞中的硼原子个数为:
![]() ,故这种超导材料的化学式为MgB2,故D正确;
,故这种超导材料的化学式为MgB2,故D正确;
本题答案为:C。

 期末集结号系列答案
期末集结号系列答案【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有_________、___________。
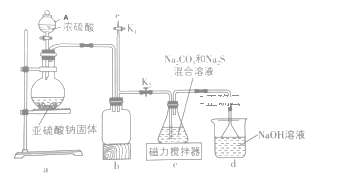
Ⅱ.测定中和热的实验装置如下图所示。
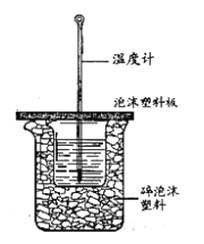
(3)大小烧杯之间填满碎泡沫塑料的作用是________,从实验装置上看,图中缺少的一种玻璃仪器________。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____℃ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②通过计算可得中和热△H=___________(精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是____。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_________(填“偏大”、“偏小”、“不受影响”)。