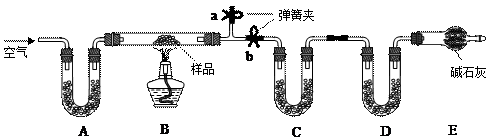
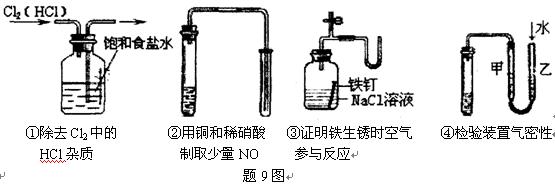
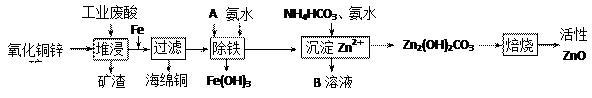题目内容
工业上制取CuCl2的生产流程如下:
请结合下表数据,回答问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
 溶度积/25℃ 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
A→B ; B→C+D 。
(2)溶液A中加入NaClO的目的是 。
(3)在溶液B中加入CuO的作用是 。
(4)操作①应控制的pH范围是: ;操作②的目的是 。
(5)由Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用“稍多量盐酸”和“低温蒸干”的目的是 。
(1)2Fe2++ClO-+2H+ = 2Fe3++Cl-+H2O (2分) CuO+2H+ = Cu2++H2O (2分)
(2)将Fe2+氧化为Fe3+,使后一步沉淀Fe(OH)3更彻底 (3分)
(3)调节溶液的pH为3~4(或4<pH<6.4),使Fe3+完全转变为Fe(OH)3沉淀而除去Fe3+ (3分)
(4)大于或等于6.4(或≥6.4)(2分) 洗涤Cu(OH)2表面的可溶性杂质 (2分)
(5)抑制Cu2+的水解,防止CuCl2晶体中含有Cu(OH)2杂质 (3分)
(2)将Fe2+氧化为Fe3+,使后一步沉淀Fe(OH)3更彻底 (3分)
(3)调节溶液的pH为3~4(或4<pH<6.4),使Fe3+完全转变为Fe(OH)3沉淀而除去Fe3+ (3分)
(4)大于或等于6.4(或≥6.4)(2分) 洗涤Cu(OH)2表面的可溶性杂质 (2分)
(5)抑制Cu2+的水解,防止CuCl2晶体中含有Cu(OH)2杂质 (3分)
略

练习册系列答案
相关题目
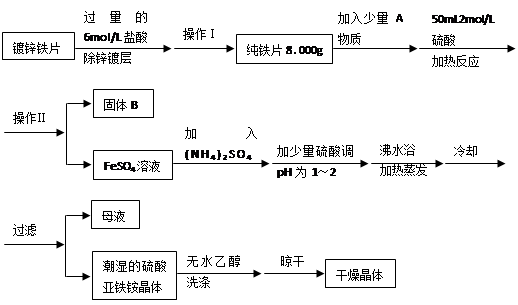
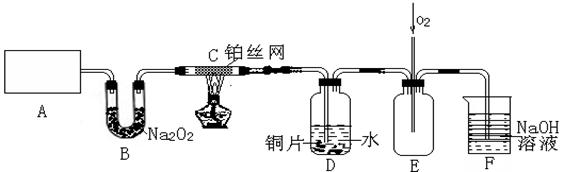 (3)D中铜片发生反应的离子方程式为___________________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的___________(填下列各项序号)
(3)D中铜片发生反应的离子方程式为___________________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的___________(填下列各项序号)