题目内容
17.下列说法不正确的是( )| A. | 常温下,等浓度的氯化铵和氟化铵溶液中铵离子浓度前者大 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$的值减小 | |
| C. | 常温下,pH相等的醋酸钠和碳酸氢钠溶液前者的物质的量浓度较大 | |
| D. | 常温下,NaClO溶液中:c(HClO)+c(ClO-)=c(Na+) |
分析 A.氟化铵中氟离子和铵根离子都水解,而氯化铵中只有铵根离子水解;
B.稀释过程中氢离子的物质的量增大,而醋酸分子的物质的量减小;
C.醋酸根离子的水解程度小于碳酸氢钠,浓度相等时醋酸钠溶液的pH小于碳酸氢钠,据此判断pH相同时二者浓度大小;
D.根据次氯酸钠溶液中的物料守恒判断.
解答 解:A.由于氟化铵中氟离子和铵根离子都水解,而氯化铵中只有铵根离子水解,则氯化铵溶液中的离子浓度大于氟化铵,故A正确;
B.醋酸在稀释过程中,醋酸的电离程度增大,则氢离子的物质的量增大,而醋酸分子的物质的量减小,由于在同一溶液中,则$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$的值增大,故B错误;
C.醋酸钠的水解程度小于碳酸氢钠,相同浓度时醋酸钠溶液的pH小于碳酸氢钠,则pH相同时醋酸钠的浓度大于碳酸氢钠,故C正确;
D.根据NaClO溶液中的物料守恒可得:c(HClO)+c(ClO-)=c(Na+),故D正确;
故选B.
点评 本题考查了离子浓度大小比较、盐的水解原理及其应用、弱电解质的电离,题目难度中等,注意掌握弱电解质的电离平衡及其影响,明确盐的水解原理、物料守恒在判断离子浓度大小中的应用方法.

练习册系列答案
相关题目
8.在由Fe、FeO和Fe2O3组成的混合物中加入100mL2mol•L-1的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况下),此时溶液中无Fe3+离子.则下列判断正确的是( )
| A. | 混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3 | |
| B. | 反应后所得溶液中的Fe2+离子与Cl-离子的物质的量之比为1:2 | |
| C. | 混合物里,FeO的物质的量无法确定,但Fe和Fe2O3的物质的量一样多 | |
| D. | 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
5.下表是某糕点的营养成分,下列有关说法正确的是( )
| 营养素 | 每100g含有 |
| 蛋白质 | 4.8g |
| 油脂 | 20g |
| 糖类 | 40g |
| -胡萝卜素 (维生素类) | 1.8g |
| 碳酸钙 | 400mg |
| A. | 油脂是高级脂肪酸的甘油酯 | |
| B. | 糖类是产生能量最高的营养物质 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物 | |
| D. | 蛋白质在人体内水解最终生成二氧化碳和水 |
12.Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),该反应的平衡常数K=64,在1L恒容密闭容器甲和乙中,甲中加有四种物质各1mol,乙中加有Fe2O3,Fe,CO2各1mol,CO 2mol.达平衡后,两容器中不等的是( )
| A. | 用CO表示反应速率 | B. | 平衡混合气体的平均相对分子质量 | ||
| C. | CO的转化率 | D. | CO2的体积分数 |
2.奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关说法中正确的是( )


| A. | 1mol奎尼酸与足量钠反应生成56L氢气 | |
| B. | 奎尼酸能使溴的四氯化碳溶液褪色 | |
| C. | 与乙醇、乙酸均能发生取代反应 | |
| D. | 不能用碳酸氢钠溶液鉴别奎尼酸和苯 |
6.下列物质中,属于非电解质的是( )
| A. | 金 | B. | 酒精 | C. | 硫酸 | D. | 氯化钠 |
7.下列反应属于取代反应的是( )
| A. | 乙烯→乙醇 | B. | 乙酸→乙酸乙酯 | C. | 苯→环己烷 | D. | 乙醇→乙醛 |
 ;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O. ,画出C元素的原子结构示意图
,画出C元素的原子结构示意图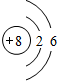 ;
;