题目内容
【题目】发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1 ②N2H4(g)+O2(g)= N2(g)+2H2O(g) △H=-534kJ·mol-1下列关于肼和NO2反应的热化学方程式中,正确的是( )
A. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) △H= -1135.7kJ·mol-1
B. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1000.3kJ·mol-1
C. N2H4(g)+NO2(g)= ![]() N2(g)+2H2O(l) △H= -500.15kJ·mol-1
N2(g)+2H2O(l) △H= -500.15kJ·mol-1
D. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1135.7kJ·mol-1
【答案】D
【解析】已知:
①N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
根据盖斯定律可知2×②-①即得到反应2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)的△H=2×②-①=2×(-534kJ/mol)-(+67.7kJ/mol)=-1135.7kJ/mol,答案选D。

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果: 
序号 | A | B | 烧杯中的液体 | 灵敏电流计指针是否偏转 |
1 | Zn | Cu | 稀硫酸 | 有 |
2 | Zn | Cu | 乙醇 | 无 |
3 | Cu | C | 氯化钠溶液 | 有 |
4 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验1中电流由极流向极(填“A”或“B”)
(2)实验4中电子由B极 流向A极,表明负极是电极(填“镁”或“铝”)
(3)实验3 表明
A.铜在潮湿空气中不会被腐蚀
B.铜的腐蚀是会发生的
(4)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一旦做负极
B.失去电子的电极是负极
C.烧杯中的溶液,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3* | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时 的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时 的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需__________________________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏小的操作是____________________(填序号)
a.定容时俯视刻度线 b.量取浓硫酸时,俯视刻度线
c.当容置瓶中液体占容积2/3左右时,未振荡摇匀 d.转移溶液时,没有等溶液冷却至室温
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是_____________________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平)
____________________________________________________________Na2SO4.
【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.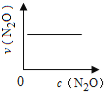 B.
B. C.
C. D.
D.