题目内容
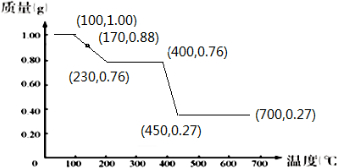
12.称取含有结晶水的草酸镁(MgC2O4•nH2O)样品(代号A)1.00克后,由25℃徐徐加热至700℃.在加热过程中,不断通入一大气压的惰性气体,结果A的质量随温度的增高而减少的情况如下表所示.已知A在100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水.| 温度/℃ | 25 | 170 | 230 | 400 | 450 | 700 |
| 质量/g | 1.00 | 0.88 | 0.76 | 0.76 | 0.27 | 0.27 |
(2)MgC2O4的相对分子质量为112.A的化学式是MgC2O4•2H2O.
(3)写出样品在400℃~450℃间发生的化学反应方程式:MgC2O4$\frac{\underline{\;\;\;\;\;稀有气体\;\;\;\;\;}}{400℃~450℃}$MgO+CO↑+CO2↑.
分析 A在100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水,则图中应存在(100,1.00)点,即25℃~100℃为水平线,230℃时完全失去结晶水,固体为MgC2O4,温度再升高,MgC2O4分解,若最后固体为X,由Mg原子守恒可知,$\frac{0.76g}{112g/mol}$:$\frac{0.27g}{M(X)}$=1:1,解得M(X)=40,即最后固体为MgO,所以最后加热时MgC2O4分解生成MgO(s)及C的氧化物,以此来解答.
解答 解:(1)A在100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水,则图中应存在(100,1.00)点,即25℃~100℃为水平线,230℃时完全失去结晶水,固体为MgC2O4,230℃~400℃固体的质量为0.76g,温度再升高,MgC2O4分解,若最后固体为X,由Mg原子守恒可知,$\frac{0.76g}{112g/mol}$:$\frac{0.27g}{M(X)}$=1:1,解得M(X)=40,即最后固体为MgO,以温度为横轴(X),质量为纵轴(Y),绘出样品A的质量随温度而改变的图 ,
,
故答案为: ;
;
(2)由230℃~400℃固体的质量为0.76g,可知此时完全失去结晶水,则
MgC2O4•nH2O$\frac{\underline{\;\;\;\;\;稀有气体\;\;\;\;\;}}{230℃-400℃}$MgC2O4+nH2O
1.00g 0.76g 0.24g,
由化学计量数之比等于物质的量的比可知,
$\frac{0.76}{112}$:$\frac{0.24}{18}$=1:n,解得n=2,
即A的化学式为MgC2O4•2H2O,
故答案为:MgC2O4•2H2O;
(3)样品在400℃~450℃间,发生MgC2O4$\frac{\underline{\;\;\;\;\;稀有气体\;\;\;\;\;}}{400℃~450℃}$X(s)+Y(g)+Z(g),由Mg原子守恒可知,$\frac{0.76g}{112g/mol}$:$\frac{0.27g}{M(X)}$=1:1,解得M(X)=40,即最后固体为MgO,结合C原子守恒及C元素的化合价变化可知,生成CO、CO2,即该反应为MgC2O4$\frac{\underline{\;\;\;\;\;稀有气体\;\;\;\;\;}}{400℃~450℃}$MgO+CO↑+CO2↑,
故答案为:MgC2O4$\frac{\underline{\;\;\;\;\;稀有气体\;\;\;\;\;}}{400℃~450℃}$MgO+CO↑+CO2↑.
点评 本题考查物质的组成的推断,涉及化学反应的计算,为高频考点,把握表格中数据及质量、物质的量、化学计量数的关系等为解答的关键,侧重分析与计算能力的考查,题目难度中等.

| A. | 25℃时,用惰性电极电解某浓度的NaOH溶液,一小段时间后,NaOH溶液的浓度可能增大,也可能不变 | |
| B. | 实验室里需要480 mL 2.0 mol/L的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、定容、摇匀等步骤进行操作 | |
| C. | 配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水 | |
| D. | 实验室配制500 mL 0.2 mol/L的硫酸亚铁溶液,其操作是:用天平称27.8 g绿矾,放入500 mL容量瓶,加水溶解、稀释、定容、摇匀 |
| A. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 过氧化钠是强氧化剂,能氧化二氧化碳,因此过氧化钠可作呼吸面具中的供氧剂 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
| A. | 甲苯与溴蒸汽的反应 | B. | H2和Cl2反应 | ||
| C. | 乙烯与氧气的反应 | D. | 乙酸乙酯的水解 |
| A. | 3mol | B. | 1.5mol | C. | 2mol | D. | 4mol |
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 对容量瓶内液体定容时,俯视读数导致物质的量浓度偏大 |
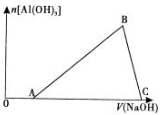
| A. | 盐酸与铝片反应后,盐酸还有剩余 | |
| B. | 图中B点之前发生的离子反应为Al3++3OH-═Al(OH)3↓ | |
| C. | A→B段消耗的NaOH体积与B→C段消耗的Na 0 H体积比≥3:1 | |
| D. | 溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等 |