题目内容
19.下列关于反应热的说法正确的是( )| A. | 当△H<0时,表示该反应为吸热反应 | |
| B. | 已知C(s)+O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
分析 A、△H<0时,反应为放热反应;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,碳燃烧应该生成稳定的二氧化碳;
C、反应热取决于反应物和生成物的总能量相对大小;
D、物质能量一定,对于确定的反应,反应热只与体系始态和终态有关,与变化途径无关.
解答 解:A、△H<0的反应为放热反应,故A错误;
B、燃烧热的含义:完全燃烧1mol物质生成最稳定的氧化物所放出的能量,碳的燃烧热应该是生成二氧化碳时所放出的能量,故B错误;
C、反应热取决于反应物和生成物的能量大小关系,当反应物能量大于生成物能量,反应为放热反应,反之则为吸热反应,故C错误;
D、根据盖斯定律可知化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关,故D正确.
故选D.
点评 本题考查反应热,注意反应热和焓变知识是热化学部分的重点,学生可以根据所学知识解答,注意平时知识的积累是关键.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
9.实验室中某些气体的制取、除杂及收集装置如图所示.仅用此装置和表中提供的物质完成相关实验,最合理的是( )
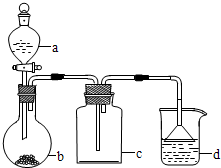

| 选项 | a种物质 | b种物质 | c种物质 | d中收集的气体 |
| A | 浓氨水 | NaOH | 浓硫酸 | NH3 |
| B | 稀盐酸 | CaCO3 | 浓硫酸 | CO2 |
| C | 稀硝酸 | Cu | 碱石灰 | NO |
| D | 浓盐酸 | KMnO4 | 水 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
10. 学生设计了下图所示的方法对A盐进行鉴定
学生设计了下图所示的方法对A盐进行鉴定
由此分析,下列结论中,正确的是( )
 学生设计了下图所示的方法对A盐进行鉴定
学生设计了下图所示的方法对A盐进行鉴定由此分析,下列结论中,正确的是( )
| A. | A中一定有Fe3+ | B. | C中一定有Cu2+ | ||
| C. | B一定为AgCl沉淀 | D. | A一定为CuCl2溶液 |
7.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | Na+、Mg2+、NO3-、SO32- | B. | K+、Cl-、NO3-、Fe2+ | ||
| C. | NH4+、Al3+、NO3-、SO42- | D. | K+、Na+、HCO3-、NO3- |
14.锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的氢离子浓度为0.1mol/L,下列叙述不正确的是( )
| A. | 反应中共转移3 mol电子 | B. | 反应中共消耗1.8 mol H2SO4 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 气体甲中SO2与H2的体积比为4:1 |
11.下列关于实验的描述错误的是( )
| A. | 将硫酸铜溶液加热蒸发、浓缩、冷却结晶,可以制备硫酸铜晶体 | |
| B. | 测定等浓度NaClO溶液和Na2SO4溶液的pH,比较Cl、S元素的非金属性强弱 | |
| C. | 萃取法除去NaBr溶液中的少量NaI,需要用烧杯、玻璃棒、胶头滴管、分液漏斗 | |
| D. | 检验Na2SO3固体是否被部分氧化:取少量固体溶于水,滴加过量稀盐酸,观察是否产生气泡,再滴加BaCl2溶液,观察是否产生白色沉淀 |
8.NO2是强氧化剂,在氧化还原反应中常被还原为NO,现有一瓶充满NO2的集气瓶,向瓶中加入适量某物质后,将集气瓶用瓶塞塞号,观察到瓶内红棕色消失,如果打开瓶塞,瓶内气体又会变为红棕色,向瓶中加入的某物质可能是( )
| A. | 四氧化碳 | B. | 蒸馏水 | C. | 二氧化碳 | D. | 二氧化硫 |
9.下列有关电子云和原子轨道的说法正确的是( )
| A. | 电子云图中,小点密集表示该处的电子多 | |
| B. | 原子轨道表示原子核外电子运动的轨迹 | |
| C. | 3p轨道和2p轨道都呈纺锤形,3p轨道比2p轨道数目多 | |
| D. | 多电子原子中电子离核的平均距离4s>3s>2s |
