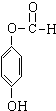
题目内容
7.在无色透明的强酸性溶液中,能大量共存的离子组是( )| A. | Na+、Mg2+、NO3-、SO32- | B. | K+、Cl-、NO3-、Fe2+ | ||
| C. | NH4+、Al3+、NO3-、SO42- | D. | K+、Na+、HCO3-、NO3- |
分析 强酸性溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.H+、NO3-、SO32-发生氧化还原反应,不能大量共存,故A错误;
B.H+、NO3-、Fe2+发生氧化还原反应,且Fe2+为浅绿色,与无色不符,故B错误;
C.该组离子之间不反应,可大量共存,且离子均为无色,故C正确;
D.H+、HCO3-结合生成水和气体,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
18.下列物质中含离子键的是( )
| A. | HCl | B. | NaF | C. | CH4 | D. | NH3 |
15.下列用来表示物质变化的化学用语中,正确的是( )
| A. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ | |
| B. | HS-水解的离子方程式:HS-+H2O?S2-+H3O+ | |
| C. | CO32-水解的离子方程式:CO32-+2 H2O?H2CO3+2OH- | |
| D. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq) |
2.下列说法或解释不正确的是( )
| A. | 物质的量浓度均为1 mol•L-1的NaCl和MgCl2中:c(Cl-)=3c(Na+) | |
| B. | 等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
12.下列元素的最高价氧化物溶于水,形成的含氧酸的酸性最强的是( )
| A. | 原子最外层电子数是次外层电子数2倍的元素 | |
| B. | 原子M层电子数等于L层和K层电子数之差的元素 | |
| C. | 第三周期ⅦA族的元素 | |
| D. | 最高正价和最低负价的绝对值之差为2的元素 |
19.下列关于反应热的说法正确的是( )
| A. | 当△H<0时,表示该反应为吸热反应 | |
| B. | 已知C(s)+O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
17.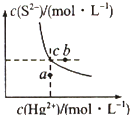 硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
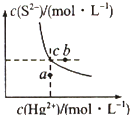 硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小 | |
| B. | 图中a点对应的是饱和溶液 | |
| C. | 向c点的溶液中加入Hg(NO3)2,则c(S2-)减小 | |
| D. | 升高温度可以实现c点到b点的转化 |
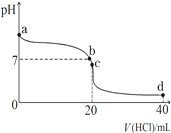 (1)明矾可用于净水,用离子方程式解释其原因Al3++3H2O?Al(OH)3(胶体)+3H+.把FeCl3溶液蒸干、灼烧、最后得到的主要固体产物是Fe2O3.
(1)明矾可用于净水,用离子方程式解释其原因Al3++3H2O?Al(OH)3(胶体)+3H+.把FeCl3溶液蒸干、灼烧、最后得到的主要固体产物是Fe2O3.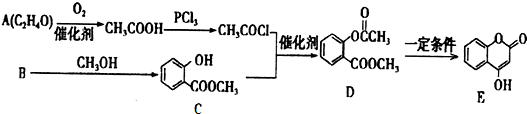
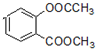 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.