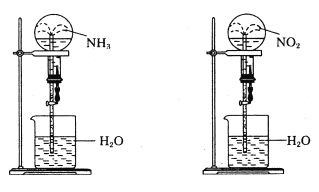
题目内容
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使充分反应,反应放出的能量总小于上述数值,为什么___________?
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10分钟后,生成10 mol 氨气,则用氮气表示的化学反应速率是________ mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大程度
(5)根据题目所给条件,判断影响该反应速率的因素有________、________、__________。
【答案】92 该反应是可逆反应,1 mol氮气和3 mol 氢气不能完全反应,放出的能量总是小于92 kJ 0.25 acf 温度 压强 催化剂
【解析】
(1)根据断键吸热、形成化学键放热分析解答;
(2)根据反应是可逆反应分析解答;
(3)根据v=△c/△t结合反应速率之比是化学计量数之比计算;
(4)根据平衡状态的含义、特征分析解答;
(5)根据影响反应速率的外界条件分析解答。
(1)由化学方程式3H2(g)+N2(g)![]() 2NH3(g)可知,1mol氮气完全反应需要消耗3 mol氢气,可生成2 mol 氨气。拆开3 mol H—H键和1 mol N≡N键需要吸收的能量为436 kJ×3+946 kJ=2254 kJ,但是生成2 mol氨气即生成6 mol N—H键可放出能量391 kJ×6=2346 kJ,因此放出的能量为2346 kJ-2254 kJ=92 kJ。
2NH3(g)可知,1mol氮气完全反应需要消耗3 mol氢气,可生成2 mol 氨气。拆开3 mol H—H键和1 mol N≡N键需要吸收的能量为436 kJ×3+946 kJ=2254 kJ,但是生成2 mol氨气即生成6 mol N—H键可放出能量391 kJ×6=2346 kJ,因此放出的能量为2346 kJ-2254 kJ=92 kJ。
(2)由于该反应是可逆反应,1 mol氮气和3 mol氢气不能完全反应,因此放出的能量总是小于92 kJ 。
(3)Δc(NH3)=10 mol÷2 L=5 mol·L-1,v(NH3)=5 mol·L-1÷10 min=0.5 mol·L-1·min-1,反应速率之比是化学计量数之比,则v(N2)=1/2v(NH3)=0.25 mol·L-1·min-1。
(4)a.反应达到化学平衡时正反应速率和逆反应速率相等,a正确;
b.反应达到化学平衡时正反应速率和逆反应速率相等,但不为0,b错误;
c.反应达到化学平衡时氮气的转化率达到最大值,c正确;
d.反应达到化学平衡时氮气和氢气的浓度不再发生变化,但二者不一定相等,d错误;
e.反应达到化学平衡时N2、H2和NH3的体积分数不再发生变化,但不一定相等,e错误;
f.反应达到化学平衡时即表明反应达到最大程度,f正确;
答案选acf;
(5)根据题意“反应条件是高温、高压,并且需要合适的催化剂”可知该反应的速率受温度、压强和催化剂的影响。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,最易失电子的元素是________,非金属性最强的元素是______;
(2)化学性质最不活泼的元素是_____,其原子的原子结构示意图为________;
(3)元素的最高价氧化物对应的水化物中酸性最强的是____,碱性最强的是___,呈两性的氢氧化物是_______________;(填写化学式)
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5在⑦与⑩的单质中,氧化性较强的是_______________,用反应化学方程式证明:_____________________________。