题目内容
【题目】由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):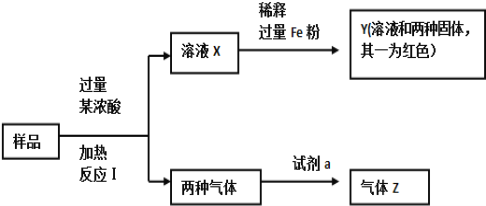
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)______________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是_______________________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_________________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)___________________________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是________________________。
【答案】AlC+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2ONO CO2Cu2+ Fe3+ H+2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
CO2↑+2SO2↑+2H2ONO CO2Cu2+ Fe3+ H+2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
【解析】
(1)无论加什么浓酸(硫酸和硝酸),溶液X中都可能含有Fe3+ 、Cu2+、Al3+三种金属阳离子;向溶液X中加入过量的NaOH溶液,可转化为Fe(OH)3和Cu(OH)2沉淀析出;如果有Al3+,则可转化为AlO2-离子,如果取上层清液通入CO2后,会发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,产生白色沉淀Al(OH)3,题给信息实验结果无明显变化,所以可以肯定溶液X中没有AlO2-,样品中没有Al;因此,本题正确答案是: Al 。
(2) ①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则z为CO2,两种气体中一种与NaHCO3溶液生成CO2,应为SO2,则浓酸为浓硫酸;反应I中能同时生成两种气体的化学方程式是:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O ;正确答案:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O ;正确答案:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
②若Z为两种气体的混合物,试剂a为适量水,则其中一种为NO2, NO2与水反应生成硝酸和NO,所以气体Z为NO、CO2化合物,则浓酸为浓硝酸;因此,本题正确答案是: NO、CO2。
(3)向溶液X中加过量Fe粉,得Y溶液和两种固体,且一种固体为红色Cu,另一种就是过量的Fe粉,这个过程发生了置换反应:Cu2++Fe=Cu+Fe2+,向Y溶液中通入过量氯气,并不断搅拌,会发生如下反应:Cl2+2Fe2+=2Cl-+2Fe3+、2Fe3++Cu=2Fe2+ Cu2+、Cl2+H2O=HCl+HClO,充分反应后,溶液中的阳离子是: Cu2+、Fe3+、 H+;因此,本题正确答案是: Cu2+、Fe3+、H+ 。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成;I-、Fe2+共同还原H2O2,当消耗2molI-时,共转移3mol电子,转移3mol电子其中2mol来自I-,另外1mol电子来自Fe2+,即氧化的I-与Fe2+之比是2:1,需要H2O2再提供3mol电子;反应方程式: 2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2;正确答案:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
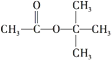
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】己二酸( )是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
)是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
![]() 8NO↑+7H2O
8NO↑+7H2O

可能用到的有关数据如下:
物质 | 密度(20 ℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
环己醇 | 0.962 g·cm-3 | 25.9 ℃ | 160.8 ℃ | 20 ℃ 时水中溶解度 3.6 g,可混溶于乙醇、苯 | 100 |
己二酸 | 1.36 g·cm-3 | 152 ℃ | 337.5 ℃ | 在水中的溶解度:15 ℃ 时1.44 g,25 ℃ 时 2.3 g,易溶于乙醇,不溶于苯 | 146 |
实验步骤如下:Ⅰ.在三口烧瓶中加入 16 mL 50%的硝酸(密度为 1.31 g·cm-3),再加入1~2粒沸石,滴液漏斗中盛放有 5.4 mL 环己醇。Ⅱ.水浴加热三口烧瓶至 50 ℃ 左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60~65 ℃ 之间。Ⅲ.当环己醇全部加入后,将混合物用80~90 ℃ 水浴加热约 10 min(注意控制温度),直至无红棕色气体生成为止。Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。Ⅴ.粗产品经提纯后称重为 5.7 g。
请回答下列问题:
(1)仪器b的名称为___________________________________________________。
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则,可能造成较严重的后果,试列举一条可能产生的后果:_______________________。
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为2NO2+2NaOH===NaNO2+NaNO3+H2O,NO+NO2+2NaOH===2NaNO2+H2O。如果改用纯碱溶液,吸收尾气时也能发生类似反应,则相关反应方程式为________ 、_____________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________ 法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同