题目内容
【题目】(1)基态Ga原子中能量最高的能层符号________ 有______ 种不同能量的电子,Ga元素与同周期相邻元素Zn、Ge相比,第一电离能从大到小的顺序__________,(用元素符号表示)金属Zn晶体采用六方最密堆积,其密置层堆积方式为__________ (ABABAB或ABCABC)区分晶体和非晶体最可靠的科学方法是________________。
(2)磷有三种含氧酸 H3PO2 、 H3PO3 、 H3PO4 其中磷原子均以sp3杂化与相邻原子形成四个α 键,则①H3PO3的结构式是__________;②写出H3PO2 与足量强氧化钠溶液反应的化学方程式_________;③三种酸的强弱顺序为H3PO2 <H3PO3 < H3PO4,其原因是___________;④HNO3 、 HNO2 中心原子的杂化方式分别为__________。
(3)金属铜投入氨水或过氧化氢溶液中均无明显现象,但投入氨水和过氧化氢的混合溶液中,则铜片溶解,溶液呈深蓝色。①写出该反应的离子反应方程式____________________________ ;②已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是_______________。
【答案】 N 8 Zn>Ge>Ga ABABAB X射线衍射实验 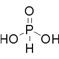 NaOH+H3PO2=NaH2PO2+H2O H3PO2 、 H3PO3 、 H3PO4 中磷元素的化合价依次为+1、+3、+5,中心磷原子的正电荷依次升高,导致P-O-H中氧原子的电子更易向磷原子偏移,因而更易电离出氢离子,酸性越来越强 sp2 Cu + 4NH3H2O +H2O2 = [Cu(NH3)4]2+ +2OH- + 4H2O (或Cu + 4NH3 +H2O2 = [Cu(NH3)4]2+ +2OH-) F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子对其孤对电子吸引能力强,难以形成配位键
NaOH+H3PO2=NaH2PO2+H2O H3PO2 、 H3PO3 、 H3PO4 中磷元素的化合价依次为+1、+3、+5,中心磷原子的正电荷依次升高,导致P-O-H中氧原子的电子更易向磷原子偏移,因而更易电离出氢离子,酸性越来越强 sp2 Cu + 4NH3H2O +H2O2 = [Cu(NH3)4]2+ +2OH- + 4H2O (或Cu + 4NH3 +H2O2 = [Cu(NH3)4]2+ +2OH-) F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子对其孤对电子吸引能力强,难以形成配位键
【解析】分析:了解核外电子的运动状态及其排布规律,了解第一电离能的变化规律,了解晶体中结构粒子的堆积方式,根据中心原子的杂化类型判断分子的结构,根据分子结构判断键的极性强弱,根据价层电子对互斥理论判断中心原子的杂化类型。
详解:(1)基态Ga原子的价电子排布式为4s24p1,故其能量最高的能层符号N ;基态Ga原子共有1s、2s、2p、3s、3p、3d、4s、4p等8种能级,故有8种不同能量的电子。同一周期的第一电离能呈逐渐增大的趋势,由于Zn的价电子排布处于全充满状态,故其第一离能高于邻近的两种元素,所以,Ga元素与同周期相邻元素Zn、Ge相比,第一电离能从大到小的顺序Zn>Ge>Ga,金属Zn晶体采用六方最密堆积,其密置层堆积方式为ABABAB,区分晶体和非晶体最可靠的科学方法是X射线衍射实验。
(2)磷有三种含氧酸 H3PO2 、 H3PO3 、 H3PO4 ,其中心原子磷原子的价层电子对数均为4(![]() ),故磷原子均以sp3杂化与相邻原子形成四个α 键,则①H3PO3的结构式是
),故磷原子均以sp3杂化与相邻原子形成四个α 键,则①H3PO3的结构式是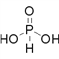 ;②H3PO2是一元酸,其与足量强氧化钠溶液反应的化学方程式为NaOH+H3PO2=NaH2PO2+H2O,③三种酸的强弱顺序为H3PO2<H3PO3<H3PO4,其原因是:H3PO2 、 H3PO3 、 H3PO4 中磷元素的化合价依次为+1、+3、+5,中心磷原子的正电荷依次升高,导致P-O-H中氧原子的电子更易向磷原子偏移,O-H键的极性更强,因而更易电离出氢离子,酸性越来越强;④HNO3 、 HNO2 中心原子的价层电子对数均为
;②H3PO2是一元酸,其与足量强氧化钠溶液反应的化学方程式为NaOH+H3PO2=NaH2PO2+H2O,③三种酸的强弱顺序为H3PO2<H3PO3<H3PO4,其原因是:H3PO2 、 H3PO3 、 H3PO4 中磷元素的化合价依次为+1、+3、+5,中心磷原子的正电荷依次升高,导致P-O-H中氧原子的电子更易向磷原子偏移,O-H键的极性更强,因而更易电离出氢离子,酸性越来越强;④HNO3 、 HNO2 中心原子的价层电子对数均为![]() 3,故其杂化方式均为sp2。
3,故其杂化方式均为sp2。
(3)金属铜投入氨水或过氧化氢溶液中均无明显现象,但投入氨水和过氧化氢的混合溶液中,则铜片溶解,溶液呈深蓝色,说明铜、氨水、过氧化氢能反应生成[Cu(NH3)4]2+,①该反应的离子反应方程式为Cu + 4NH3H2O +H2O2 = [Cu(NH3)4]2+ +2OH- + 4H2O(或Cu + 4NH3 +H2O2 = [Cu(NH3)4]2+ +2OH-) ,②已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子对其孤对电子吸引能力强,难以形成配位键。

【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同