题目内容
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。

(1)装置A中仪器a的名称为________。写出A中发生反应的离子方程式_________________________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理_______________________________________。
(2)选用图中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是__________________________________。
②丙同学设计的合理实验方案为:按照A→C→______→F→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是____________________________。
③其中裝置C的作用是____________________________。
(3)为了测定装置A残液中SO2的含量,量取10.00mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00mL0.0500mol·L-1的KMnO4溶液吸收。充分反应后,再用0.2000 mol·L-1的KI标准溶液滴定过量的KMnO4,消耗KI溶液20.00mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ 10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为____g·L-1。
②若滴定前读数时平视,滴定终点读数时俯视则测定结果________(填“偏高”、“偏低”或“无影响”)。
【答案】 分液漏斗 CaSO3+2H+=Ca2++H2O+ SO2↑ SO2+2H2S=3S↓+2H2O 次氯酸在水溶液中能将SO2氧化,并非强酸制弱酸 B→E→D F中有沉淀后溶解,D不变色 除去挥发HCl 3.2 偏高
【解析】试题分析:(1)根据装置A分析仪器a的名称;A中亚硫酸钙与盐酸反应生成氯化钙、二氧化硫、水;SO2与H2S反应生成硫单质,能证明+4价的硫元素具有氧化性;(2)①次氯酸在水溶液中能将SO2氧化;②根据亚硫酸酸性大于碳酸、碳酸酸性大于次氯酸验证亚硫酸与次氯酸的酸性强弱;(3)①根据电子守恒计算SO2的含量;②若滴定前读数时平视,滴定终点读数时俯视,消耗KI溶液体积偏小;
解析:(1)装置A中仪器a的名称分液漏斗;A中亚硫酸钙与盐酸反应生成氯化钙、二氧化硫、水,反应的离子方程式是CaSO3+2H+=Ca2++H2O+ SO2↑;SO2与H2S反应生成硫单质,能证明+4价的硫元素具有氧化性,反应方程式是SO2+2H2S=3S↓+2H2O;次氯酸在水溶液中能将SO2氧化,并非强酸制弱酸。所以按A→C→F→尾气处理顺序连接装置,不能证明亚硫酸和次氯酸的酸性强弱;②根据亚硫酸酸性大于碳酸、碳酸酸性大于次氯酸验证亚硫酸与次氯酸的酸性强弱;A中生成的SO2气体通过饱和NaHSO3溶液除去HCl,再通过饱和NaHCO3溶液生成二氧化碳气体,证明亚硫酸酸性大于碳酸,再通过高锰酸钾溶液除去CO2中的SO2,用品红溶液检验SO2已经除尽,再把CO2通入漂白粉溶液中,若D中品红不褪色、F中先有沉淀后溶解,证明碳酸酸性大于次氯酸;所以按照A→C→B→E→D→F→尾气处理(填字母)顺序连接装置。③其中饱和NaHCO3溶液的作用是除去挥发HCl。(3)①设10.00mL残液中SO2的质量是xg,根据电子守恒![]() ,x=0.032g,残液中SO2的含量为
,x=0.032g,残液中SO2的含量为![]() 3.2g·L-1;②若滴定前读数时平视,滴定终点读数时俯视,消耗KI溶液体积偏小,根据上式可知测定结果偏高。
3.2g·L-1;②若滴定前读数时平视,滴定终点读数时俯视,消耗KI溶液体积偏小,根据上式可知测定结果偏高。
【题型】实验题
【结束】
9
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。

回答下列问题: (1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。 (2)写出步骤Ⅰ中反应的总化学方程式为___________________________________。 (3)简述步骤Ⅱ中能析出KClO3晶体而无其他晶体析出的原因是_____________________________。 (4)已知MgCl2溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。 (5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。 (6)步骤Ⅳ中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_____。 A.N2 B.H2 C. CO2 D.空气 (7)海水中溴含量为65mg·L-1。若1L海水中95%溴元素被氧化为Br2经热空气吹出,溴单质残留量3%。最后用SO2将90%Br2还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。 【答案】 NaOH 溶液 Na2CO3溶液 Cl-+3H2O 【解析】试题分析:(1)除去Mg2+和Ca2+,可以用生成氢氧化镁、碳酸钙沉淀的方法;(2)根据电子守恒,步骤Ⅰ中电解氯化钠溶液,生成氯酸钠、氢气;(3)室温下 KClO3溶解度最小;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体;(5)通入氯化氢可以抑制氯化镁水解;(6)根据金属镁的性质分析;(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;根据溴元素守恒计算溴离子浓度; 解析:(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,可以加入氢氧化钠溶液、碳酸钠溶液;(2)根据电子守恒,步骤Ⅰ中电解氯化钠溶液,生成氯酸钠、氢气;反应的总化学方程式为Cl-+3H2O![]() ClO3-+3H2↑ 此温度下 KClO3溶解度最小 MgCl2+H2O
ClO3-+3H2↑ 此温度下 KClO3溶解度最小 MgCl2+H2O![]() Mg(OH)Cl+HCl↑ 通入氯化氢,蒸发浓缩冷却结晶 B 提高溴水的浓度 16.6倍
Mg(OH)Cl+HCl↑ 通入氯化氢,蒸发浓缩冷却结晶 B 提高溴水的浓度 16.6倍![]() ClO3-+3H2↑;(3)室温下 KClO3溶解度最小,所以向氯酸钠溶液中加入氯化钾能析出KClO3晶体而无其他晶体析出;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体,反应的化学方程式是MgCl2+H2O
ClO3-+3H2↑;(3)室温下 KClO3溶解度最小,所以向氯酸钠溶液中加入氯化钾能析出KClO3晶体而无其他晶体析出;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体,反应的化学方程式是MgCl2+H2O![]() Mg(OH)Cl+HCl↑;(5)通入氯化氢可以抑制氯化镁水解,为得到无水MgCl2,步骤Ⅲ的操作应为通入氯化氢,蒸发浓缩冷却结晶;(6)A.Mg与N2反应生成Mg3N2,故A错误; B.H2与Mg不反应,故B正确; C. CO2与Mg反应生成氧化镁和碳,故C错误; D.镁在空气中能燃烧,故D错误。(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;设所得溶液中溴离子浓度为x mg·L-1,根据溴元素守恒,
Mg(OH)Cl+HCl↑;(5)通入氯化氢可以抑制氯化镁水解,为得到无水MgCl2,步骤Ⅲ的操作应为通入氯化氢,蒸发浓缩冷却结晶;(6)A.Mg与N2反应生成Mg3N2,故A错误; B.H2与Mg不反应,故B正确; C. CO2与Mg反应生成氧化镁和碳,故C错误; D.镁在空气中能燃烧,故D错误。(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;设所得溶液中溴离子浓度为x mg·L-1,根据溴元素守恒, ![]() ,x=1078.2,所得溶液中溴离子浓度为海水中溴离子浓度的
,x=1078.2,所得溶液中溴离子浓度为海水中溴离子浓度的![]() 16.6倍;
16.6倍;
金3练系列答案
高效课堂提优训练系列答案
试题优化课堂同步系列答案
教材1加1系列答案
尖子生培优教材系列答案
走进重高培优讲义系列答案
孟建平系列一课三练课时导学系列答案
激活课堂课时作业系列答案

亮点激活教材多元演练系列答案
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。

回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ中反应的总化学方程式为___________________________________。
(3)简述步骤Ⅱ中能析出KClO3晶体而无其他晶体析出的原因是_____________________________。
(4)已知MgCl2溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。
(5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。
(6)步骤Ⅳ中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_____。
A.N2 B.H2 C. CO2 D.空气
(7)海水中溴含量为65mg·L-1。若1L海水中95%溴元素被氧化为Br2经热空气吹出,溴单质残留量3%。最后用SO2将90%Br2还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
【答案】 NaOH 溶液 Na2CO3溶液 Cl-+3H2O![]() ClO3-+3H2↑ 此温度下 KClO3溶解度最小 MgCl2+H2O
ClO3-+3H2↑ 此温度下 KClO3溶解度最小 MgCl2+H2O![]() Mg(OH)Cl+HCl↑ 通入氯化氢,蒸发浓缩冷却结晶 B 提高溴水的浓度 16.6倍
Mg(OH)Cl+HCl↑ 通入氯化氢,蒸发浓缩冷却结晶 B 提高溴水的浓度 16.6倍
【解析】试题分析:(1)除去Mg2+和Ca2+,可以用生成氢氧化镁、碳酸钙沉淀的方法;(2)根据电子守恒,步骤Ⅰ中电解氯化钠溶液,生成氯酸钠、氢气;(3)室温下 KClO3溶解度最小;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体;(5)通入氯化氢可以抑制氯化镁水解;(6)根据金属镁的性质分析;(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;根据溴元素守恒计算溴离子浓度;
解析:(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,可以加入氢氧化钠溶液、碳酸钠溶液;(2)根据电子守恒,步骤Ⅰ中电解氯化钠溶液,生成氯酸钠、氢气;反应的总化学方程式为Cl-+3H2O![]() ClO3-+3H2↑;(3)室温下 KClO3溶解度最小,所以向氯酸钠溶液中加入氯化钾能析出KClO3晶体而无其他晶体析出;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体,反应的化学方程式是MgCl2+H2O
ClO3-+3H2↑;(3)室温下 KClO3溶解度最小,所以向氯酸钠溶液中加入氯化钾能析出KClO3晶体而无其他晶体析出;(4)MgCl2溶液受热时易水解生成Mg(OH)Cl和HCl气体,反应的化学方程式是MgCl2+H2O![]() Mg(OH)Cl+HCl↑;(5)通入氯化氢可以抑制氯化镁水解,为得到无水MgCl2,步骤Ⅲ的操作应为通入氯化氢,蒸发浓缩冷却结晶;(6)A.Mg与N2反应生成Mg3N2,故A错误; B.H2与Mg不反应,故B正确; C. CO2与Mg反应生成氧化镁和碳,故C错误; D.镁在空气中能燃烧,故D错误。(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;设所得溶液中溴离子浓度为x mg·L-1,根据溴元素守恒,
Mg(OH)Cl+HCl↑;(5)通入氯化氢可以抑制氯化镁水解,为得到无水MgCl2,步骤Ⅲ的操作应为通入氯化氢,蒸发浓缩冷却结晶;(6)A.Mg与N2反应生成Mg3N2,故A错误; B.H2与Mg不反应,故B正确; C. CO2与Mg反应生成氧化镁和碳,故C错误; D.镁在空气中能燃烧,故D错误。(7)1L海水中95%溴元素转移到50mL溶液中,目的提高溴水的浓度;设所得溶液中溴离子浓度为x mg·L-1,根据溴元素守恒, ![]() ,x=1078.2,所得溶液中溴离子浓度为海水中溴离子浓度的
,x=1078.2,所得溶液中溴离子浓度为海水中溴离子浓度的![]() 16.6倍;
16.6倍;
【题型】综合题
10
【题目】碳和氯元素及其化合物与人类的生产、生活密切相关。
I、氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备氯胺(NH2Cl)气体,己知部分化学键的键能:
化学键 | N—H | CI—Cl | N—Cl | H—Cl |
键能/ kJmol-1 | 391.3 | 243.0 | 191.0 | 431.8 |
则上述反应的热化学方程式为:__________________。
(2)氯胺(g)是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为______________________。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(1)在三个容积均为1L的密闭容器中以不同的氢碳比![]() 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
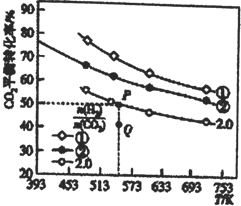
请回答下列问题:
①氢碳比①________②,Q点V(正)___v(逆),该反应的ΔH ________0,(填“大于”或“小于”)
②若起始时,CO2、H2的浓度分别为0.5mol·L-1、l mol·L-1,则P点对应温度的平衡常数的值为_____。P点对应的平衡常数__________Q点对应的平衡常数(填“>”、“<”或“=”)
(2)已知:碳酸H2CO3,K1=4.3×10-7、K2=5.6×10-11
草酸H2C2O4,K1=6.0×10-2、K2=6.0×10-5
①下列微粒可以大量共存的是___________(填字母)。
a.H2CO3、C2O42- b.CO32-、HC2O4- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________________________________。


