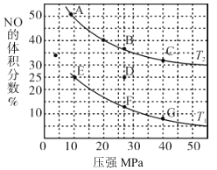
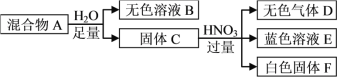题目内容
【题目】已知:
2Fe(s)+O2(g) =2FeO(s) △H=-544kJ·mol-1
4Al(s)+3O2(g) =2Al2O3(s) △H=-3350kJ·mol-1
则2Al(s) +3FeO(s) =Al2O3(s) + 3Fe(s)的△H是
A. - 859 kJ·mol-1 B. +859 kJ·mol-1
C. -1403 kJ·mol-1D. -2491 kJ·mol-1
【答案】A
【解析】
根据反应①2Fe(s)+O2(g) =2FeO(s)和反应②4Al(s)+3O2(g) =2Al2O3(s)可知,②×![]() -①×
-①×![]() 得到2Al(s) +3FeO(s) =Al2O3(s)+ 3Fe(s),所以反应热是(-3350kJ·mol-1)×
得到2Al(s) +3FeO(s) =Al2O3(s)+ 3Fe(s),所以反应热是(-3350kJ·mol-1)×![]() +544kJ·mol-1×
+544kJ·mol-1×![]() =-859 kJ·mol-1,
=-859 kJ·mol-1,
答案选A。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目